Раздел 10. Кислородсодержащие органические соединения
10.1.
Спирты (алкоголи)
Спиртами называют соединения, содержащие одну или несколько
гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
Спирты классифицируют
по различным структурным признакам.
1. По числу гидроксильных групп спирты
подразделяются на:
·
одноатомные (одна
группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
·
многоатомные (две и
более групп -ОН).
Современное
название многоатомных спиртов - полиолы (диолы, триолы и т.д).Примеры:
двухатомный
спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный
спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные
спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы
и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не
существуют.
2. В зависимости от того, с каким атомом
углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают
спирты:
Ø первичные R–CH2–OH,
Ø вторичные R2CH–OH,
Ø третичные R3C–OH.
Например:
В многоатомных спиртах различают первично-, вторично-
и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина
содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую
(–СН(ОН)–) группы.
3. По строению радикалов, связанных с атомом
кислорода, спирты подразделяются на
Ø предельные (например, СH3 –
CH2–OH)
Ø непредельные (CH2=CH–CH2–OH)
Ø ароматические (C6H5CH2–OH)
Непредельные
спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной
связью, очень неустойчивы и сразу же изомеризуются в альдегиды или
кетоны.
Например,
виниловый спирт CH2=CH–OH превращается
в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
ПРЕДЕЛЬНЫЕ
ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных
углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула:
CnH2n+1OH или ROH или CnH2n+2O
|
Гомологический ряд
Простейшие спирты
|
||
Название
|
Формула
|
Модели
|
CH3-OH
|
||
|
Этиловый
спирт
(этанол) |
CH3CH2-OH
|
|
Номенклатура спиртов
Систематические
названия даются по названию углеводорода с добавлением суффикса -оли
цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение
ОН-группы, в русском языке обычно ставится после суффикса "ол".
По другому
способу (радикально-функциональная номенклатура) названия спиртов производят от
названий радикалов с добавлением слова "спирт". В соответствии
с этим способом приведенные выше соединения называют: метиловый спирт, этиловый
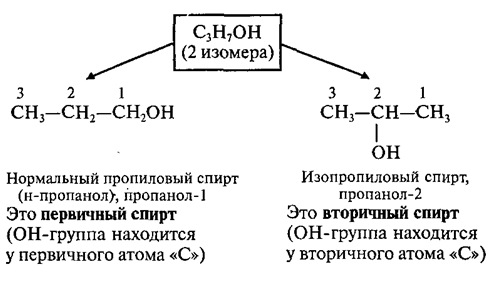
спирт, н-пропиловый спирт СН3-СН2-СН2-ОН,
изопропиловый спирт СН3-СН(ОН)-СН3.
Изомерия спиртов
Для спиртов
характерна структурная изомерия:
Ø изомерия положения ОН-группы
(начиная с С3);
Например:
Например:
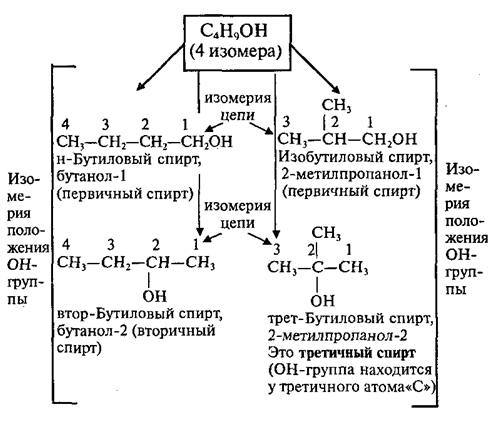
Ø углеродного скелета (начиная с С4);
Например, формуле C4H9OH соответствует изомеры:
Например, формуле C4H9OH соответствует изомеры:
Ø межклассовая изомерия с простыми
эфирами
Например,
Например,
этиловый
спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
Возможна
также пространственная изомерия – оптическая.
Например,
бутанол-2 СH3CH(OH)СH2CH3,
в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя
различными заместителями, существует в форме двух оптических изомеров.
Строение спиртов
Строение
самого простого спирта — метилового (метанола) — можно представить формулами:
Из
электронной формулы видно, что кислород в молекуле спирта имеет две
неподеленные электронные пары.
Свойства
спиртов и фенолов определяются строением гидроксильной группы, характером ее
химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и
С–О – полярные ковалентные. Это следует из различий в электроотрицательности
кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих
связей смещена к более электроотрицательному атому кислорода:
Атому кислорода в спиртах свойственна
sp3-гибридизация. В образовании его связей с атомами C и H участвуют
две 2sp3-атомные орбитали, валентный угол C–О–H близок к
тетраэдрическому (около 108°). Каждая из двух других 2 sp3-орбиталей
кислорода занята неподеленной парой электронов.
Подвижность
атома водорода в гидроксильной группе спирта несколько меньше, чем в воде.
Более "кислым" в ряду одноатомных предельных спиртов будет метиловый
(метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.
Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ = 0,793г/см3), с
запахом алкоголя, хорошо растворяется в воде. Ядовит – вызывает слепоту, смерть наступает от паралича
верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом спирта,
хорошо смешивается с водой.
Первые представители
гомологического ряда спиртов — жидкости, высшие — твердые вещества. Метанол и
этанол смешиваются с водой в любых соотношениях. С ростом молекулярной массы
растворимость спиртов в воде падает. Высшие спирты практически нерастворимы в
воде.
Особенности
строения спиртов –
спирты образуют водородные связи (обозначают точками) за счёт
функциональной группы (-ОН)
Вывод:
1) В
результате у всех спиртов более высокая температура кипения, чем у
соответствующих углеводородов, например, Т. кип. этанола +78° С,
а Т. кип.
этана –88,63° С; Т. кип. бутанола и бутана соответственно +117,4° С и –0,5° С.
2)
Способность спиртов образовывать межмолекулярные водородные связи не только
влияет на их температуры кипения, но и увеличивает их растворимость в воде. Все
алканы нерастворимы в воде, а низкомолекулярные спирты (метиловый,
этиловый, н-пропиловый и изопропиловый) растворяются в воде
неограниченно.
3) Отсутствие
газов в гомологическом ряду предельных одноатомных спиртов.
В химических
реакциях гидроксисоединений возможно разрушение одной из двух связей:
Ø С–ОН с отщеплением ОН-группы
Ø О–Н с отщеплением водорода
Это могут
быть реакции замещения, в которых происходит замена ОН или Н, или
реакцияотщепления (элиминирования), когда образуется двойная связь.
Полярный
характер связей С–О и О–Н способствует гетеролитическому их разрыву и
протеканию реакций по ионному механизму. При разрыве связи О–Н
с отщеплением протона (Н+) проявляются кислотные свойства
гидроксисоединения, а при разрыве связи С–О – свойства основания и
нуклеофильного реагента.
С разрывом
связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
I. Кислотно-основные
RO- + H+ ↔ ROH ↔ R+ + OH-
алкоголят-ион
Кислотные
свойства уменьшаются в ряду, а основные возрастают:
HOH → R-CH2-OH → R2CH-OH → R3C-OH
вода первичный вторичный третичный
|
Кислотные свойства
С активными
щелочными металлами:
2C2H5OH +
2 Na → 2C2H5ONa + H2
этилат
натрия
Алкоголяты
подвергаются гидролизу, это доказывает,
что у воды
более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH + NaOH
Основные свойства
С
галогенводородными кислотами:
C2H5OH + HBr H2SO4(конц)↔ C2H5Br + H2O
бромэтан
Лёгкость
протекания реакции зависит от природы галогенводорода и спирта – увеличение
реакционной способности происходит в следующих рядах:
HF < HCl < HBr < HI
|
первичные < вторичные < третичные
|
II. Окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты
окисляются до карбонильных соединений:
Первичные спирты
при окислении образуют альдегиды, которые затем легко окисляются до карбоновых
кислот.
При окислении вторичных спиртов
образуются кетоны.
Третичные спирты
более устойчивы к действию окислителей. Они окисляются только в жестких
условиях (кислая среда, повышенная температура), что приводит к разрушению
углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и
кетонов с меньшей молекулярной массой).
В кислой
среде:
Для
первичных и вторичных одноатомных спиртов качественной реакцией является
взаимодействие их с кислым раствором дихромата калия. Оранжевая окраска
гидратированного иона Cr2O72- исчезает и появляется
зеленоватая окраска, характерная для иона Cr3+ . Эта смена окраски позволяет
определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4 → CO2 + K2SO4 + Cr2(SO4)3 + 6H2O
3CH3-CH2-OH + K2Cr2O7 +
4H2SO4 → 3CH3COH + K2SO4 +
Cr2(SO4)3 + 7H2O
В более
жёстких условиях окисление первичных спиртов идёт сразу до карбоновых
кислот:
3CH3-CH2-OH + 2K2Cr2O7 +
8H2SO4 t→ 3CH3COOH + 2K2SO4 +
2Cr2(SO4)3 + 11H2O
Третичные
спирты устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях
(при нагревании, в кислой среде) они окисляются с расщеплением связей С-С и
образованием кетонов и карбоновых кислот.
В
нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а
остальные спирты до солей соответствующих карбоновых кислот.
3). Горение (с
увеличением массы углеводородного радикала – пламя становится всё
более коптящим)
CnH2n+1-OH + O2 t →
CO2 + H2O + Q
III. Реакции отщепления
1) Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 +
H2O
бутанол-2
бутен-2
В тех
случаях, когда возможны 2 направления реакции, например:
дегидратация
идет преимущественно в направлении I, т.е. по правилу Зайцева –
с образованием более замещенного алкена. Правило Зайцева:
Водород отщепляется от наименее гидрированного атома углерода соседствующего с
углеродом, несущим гидроксил.
2) Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
- при
переходе от первичных спиртов к третичным увеличивается склонность к
отщеплению воды и образованию алкенов; уменьшается способность образовывать
простые эфиры.
3) Реакция дегидрирование и дегидратация предельных одноатомных спиртов –реакция С.В. Лебедева
2C2H5OH 425,ZnO,Al2O3→ CH2=CH-CH=CH2 +
H2 + 2H2O
IV. Реакции этерификации
Спирты
вступают в реакции с минеральными и органическими кислотами, образуя сложные
эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Получение спиртов
I. В промышленности
1. Из
водяного газа (получение
метанола – древесный спирт)
CO + 2H2 t,p → CH3OH
2. Брожение
глюкозы (получение
этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3.
Гидратация алкенов
II. В лаборатории
Взаимодействие галогеналканов R-Г с водными растворами щелочей
CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р.
обмен)
ПРИМЕНЕНИЕ
Метанол СН3ОН – используют как растворитель,
в производстве муравьиной кислоты, а также в производстве формальдегида, применяемого
для получения фенолформальдегидных смол, в последнее время метанол
рассматривают как перспективное моторное топливо. Большие объемы метанола
используют при добыче и транспорте природного газа. Метанол – наиболее
токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь –
100 мл.
Этанол С2Н5ОН – исходное соединение для
получения ацетальдегида, уксусной кислоты, а также для производства сложных
эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол
– основной компонент всех спиртных напитков, его широко применяют и в медицине
как дезинфицирующее средство.
Многоатомные спирты – органические соединения, в
молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с
углеводородным радикалом
Гликоли (диолы)
·
Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах,
хорошо смешивается с водой, сильно понижает температуру замерзания
воды (60%-ый раствор
замерзает при -49 ˚С) –это используется в системах охлаждения двигателей –
антифризы.
·
Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки.
Триолы
Глицерин (пропантриол-1,2,3)
|
||
Формула
|
Модели
молекулы
|
|
|
шаростержневая
|
полусферическая
|
|
HOCH2-СH(OH)-CH2OH
|
||
·
Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без
запаха. Хорошо смешивается с водой.
·
Распространён в живой природе. Играет важную роль в обменных процессах, так
как входит в состав жиров (липидов) животных и растительных тканей.
Номенклатура
В названиях
многоатомных спиртов (полиолов) положение и число гидроксильных групп
указывают соответствующими цифрами и суффиксами -диол (две
ОН-группы), -триол (три ОН-группы) и т.д. Например:
Получение
многоатомных спиртов
I. Получение двухатомных спиртов
В промышленности
1. Каталитическая гидратация оксида
этилена (получение этиленгликоля):
2. Взаимодействие
дигалогенпроизводных алканов с водными растворами щелочей:
3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В лаборатории
1. Окисление алкенов:
II. Получение трёхатомных
спиртов (глицерина)
В промышленности
Омыление
жиров (триглицеридов):
Химические
свойства многоатомных спиртов
Кислотные свойства
1. С
активными металлами:
HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят
натрия)
2. С
гидроксидом меди(II) – качественная реакция!
Упрощённая схема
Основные свойства
1. С
галогенводородными кислотами
HO-CH2-CH2-OH + 2HCl H+↔ Cl-CH2-CH2-Cl + 2H2O
2. С азотной кислотой
Тринитроглицерин
- основа динамита
Применение
·
Этиленгликоль производства лавсана, пластмасс, и для приготовленияантифризов —
водных растворов, замерзающих значительно ниже 0°С (использование их для
охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в
органическом синтезе.
·
Глицерин широко используется в кожевенной,
текстильной промышленности при отделке кож и тканей и в других
областях народного хозяйства. Сорбит(шестиатомный спирт)
используется как заменитель сахара для больных диабетом.Глицерин находит
широкое применение в косметике, пищевой
промышленности,фармакологии, производстве взрывчатых
веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он
служит сырьем для получения бездымных порохов и динамита ― взрывчатого
вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит
был изобретен Нобелем, который основал известную всему миру Нобелевскую премию
за выдающиеся научные достижения в области физики, химии, медицины и
экономики. Нитроглицерин токсичен, но в малых количествах служит
лекарством, так как расширяет
сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
УПРАЖНЕНИЯ
1.
Какие продукты
получатся при нагревании смеси этилового и метилового спиртов с
концентрированной серной кислотой?
С2Н5ОН,
СН3ОН →
Решение:
Серная кислота
нужна из-за её водоотнимающих свойств. Может происходить межмолекулярная
дегидратация.
2CH3–CH2–OH → CH3–CH2–O–CH2–CH3 + H2O
2CH3–OH → CH3–O–CH3 + H2O
CH3–CH2–OH + CH3–OH → CH3–CH2–O–CH3 + H2O
Может происходить
внутримолекулярная дегидратация с образованием алкена.
CH3–CH2–OH → CH2=CH2 + H2O
________________________________________________________________
2.
________________________________________________________________
3.
________________________________________________________________
4.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какие спирты называются первичными, вторичными и третичными?
2. Какие спирты называются двух-, трех- и многоатомными? Почему
температуры кипения многоатомных спиртов гораздо выше температуры кипения
одноатомных спиртов с тем же числом атомов углерода?
3. Напишите структуры следующих спиртов и укажите, какие из них являются
первичными, вторичными и третичными: 1-бутанол; 2-бутанол; 2-метилпропанол-1;
2-метилпропанол-2; 2,2-диметилпропанол-1.
4. Напишите структурные формулы всех изомерных амиловых спиртов
состава С5Н11ОН и назовите их по номенклатуре ИЮПАК.
5. Почему температуры кипения спиртов выше, чем температуры кипения
углеводородов с таким же числом атомов углерода?
6. Напишите схему и продукты реакции 2-метилбутанола-2 с реагентами:
а) соляная кислота на холоду; б) серная кислота при слабом нагревании.
7. Назовите следующие спирты по международной
номенклатуре:
8. Напишите уравнения реакций, с помощью которых можно осуществить
следующие превращения:
9. При количественной межмолекулярной дегидратации смеси двух
одноатомных спиртов неизвестного строения выделилось10,8 г воды и образовалось
36 г смеси трех органических соединений в равных молярных соотношениях и
принадлежащих к одному и тому же классу органических соединений. Каково
строение исходных спиртов.
10. Определите массу метанола, которую можно получить из 11,2 м3
оксида углерода (II)
и 40 м3 водорода (н.у.), если выход продукта реакции равен 75 %.
ВИДЕО ОПЫТ
1.
Сколько изомерных спиртов отвечает формуле С4Н9ОН:
|
|
а) 2
|
б) 4
|
в) 3
|
г) 5
|
2.
Укажите формулу вещества, которое получается при
взаимодействии НСl с этанолом:
|
|
а) CH3Cl
|
б) CH2Cl- CH2Cl
|
в) C2H5Cl
|
г) CH2 = CHCl
|
3.
Укажите число изомерных веществ состава С3Н8О:
|
|
а) 3
|
б) 2
|
в) 4
|
г) 5
|
4.
При дегидратации изопропилового спирта образуется:
|
|
а) этилен
|
б) ацетилен
|
в) пропилен
|
г) пропин
|
5.
В каком ряду вещества названы в порядке
возрастания температуры кипения:
|
|
а) метан, метанол, хлорметан
|
б) метанол, хлорметан, метан
|
в) метан, хлорметан, метанол
|
г) хлорметан, метан, метанол
|
6.
В реакциях с каким веществом от спиртов
отщепляется группа ОН:
|
|
а) натрий
|
б) бромоводород
|
в) уксусная кислота
|
г) калий
|
7.
Какое соединение преимущественно образуется при
действии водного раствора щелочи на 2-бром-2-метилпропан:
|
|
а) 2-метилпропен
|
б) 2-метил-1-пропанол
|
в) 2-метил-2-пропанол
|
г) 2-пропанол
|
8.
Этанол нагревают с концентрированной Н2SО4
выше 1400С и полученный продукт пропускают в сосуд с
бромом. При этом образуется:
|
|
а) CH2(Br) CH2OH
|
б) CH2(Br) CH2(Br)
|
в) CH(Br2) CH(Br2)
|
г) C2H5Br
|
9.
К какому классу веществ относится нитроглицерин:
|
|
а) соль
|
б) простой эфир
|
в) сложный эфир
|
г) нитроалкан
|
10.
Укажите сумму коэффициентов в уравнении реакции
горения пропанола-1:
|
|
а) 24
|
б) 25
|
в) 26
|
г) 27
|
Ответы:
1
|
б
|
2
|
в
|
3
|
а
|
4
|
в
|
5
|
в
|
6
|
б
|
7
|
в
|
8
|
б
|
9
|
в
|
10
|
б
|













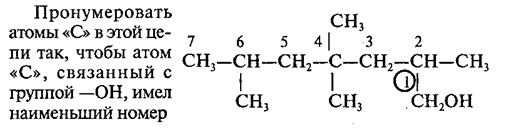


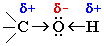










































Комментариев нет:
Отправить комментарий