9.8. Ароматические углеводороды (бензол)
Ароматические
углеводороды (Арены) –
это органические соединения, в молекулах
которых имеется одно или несколько бензольных колец. Бензольное кольцо,
или ядро, – циклическая группа атомов углерода с особым характером связей.
Общая формула - CnH2n-6
Представители:
МОНОЯДЕРНЫЕ
1. С6H6 – бензол, родоначальник
гомологического ряда аренов
2. С6H5 – CH3 – толуол (метилбензол)
3. С6H5 – CH=СH2 – стирол (винилбензол)
4. Ксилол (орто-, пара- , мета-ксилол)
МНОГОЯДЕРНЫЕ (КОНДЕНСИРОВАННЫЕ)
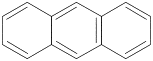
1. Нафталин
2. Антрацен
Строение ароматических углеводородов:
SP2 –гибридизация:
1. Плоское тригональное
строение
2. Угол – HCH - 120°
3. Связи σ, π
4. В бензоле нет
простых и двойных связей, под влиянием единой π – электронной системы
расстояние между центрами атомов углерода становится одинаковым – 0,139 нм,
все связи полуторные
|
Первую структурную формулу бензола
предложил в 1865 г. немецкий химик Ф.А.Кекуле:
Атомы С в молекуле бензола образуют правильный
плоский шестиугольник, хотя часто его рисуют вытянутым.
Приведенная формула правильно отражает
равноценность шести атомов С, однако не объясняет ряд особых свойств бензола.
Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям
присоединения: не обесцвечивает бромную
воду и раствор перманганата калия, т.е. ему не свойственны типичные для
непредельных соединений качественные реакции.
В структурной формуле Кекуле – три
одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое
изображение не передает истинного строения молекулы. В действительности
углерод-углеродные связи в бензоле равноценны. Это объясняется электронным
строением его молекулы.
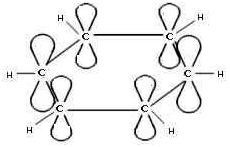
Каждый атом С в молекуле бензола находится в
состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и
атомом Н тремя σ -связями. В результате образуется плоский
шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат
в одной плоскости (угол между связями С–С равен 120o).
Схема образования -связей в молекуле
бензола
Третья p-орбиталь атома углерода не участвует в
гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости
бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под
плоскостью кольца.
Негибридные
2p-орбитали углерода в молекуле бензола
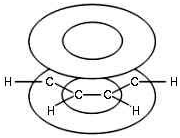
В результате шесть p-электронов (всех шести
атомов С) образуют общее π -электронное облако и единую химическую
связь для всех атомов С.
Молекула бензола. Расположение π -электронного облака
π -Электронное облако обусловливает
сокращение расстояния между атомами С.
В молекуле бензола они одинаковы и равны 0,139
нм. В случае простой и двойной связи эти расстояния составили бы соответственно
0,154 и 0,134 нм. Значит, в молекуле бензола нет чередования простых и двойных
связей, а существует особая связь – “полуторная” – промежуточная
между простой и двойной, так называемая ароматическая связь. Чтобы показать
равномерное распределение p-электронного облака в молекуле бензола, корректнее
изображать ее в виде правильного шестиугольника с окружностью внутри
(окружность символизирует равноценность связей между атомами С):
Изомерия, номенклатура
Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их
взаимным положением в бензольном кольце. Положение двух заместителей указывают
с помощью приставок: орто- (о-), если они находятся у
соседних углеродных атомов (положение 1, 2-), мета- (м-)
для разделенных одним атомом углерода (1, 3-) и пара-(п-)
для находящихся напротив друг друга (1, 4-).
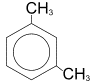
Например, для диметилбензола (ксилола):
орто-ксилол (1,2-диметилбензол)
мета-ксилол (1,3-диметилбензол)
пара-ксилол (1,4-диметилбензол)
Радикалы
ароматических углеводородов называют арильными радикалами.
РадикалС6Н5 — называется фенил.
Физические
свойства
Бензол и его ближайшие гомологи –
бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче
воды и в ней не растворяются, однако легко растворяются в органических
растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются
хорошими растворителями для многих органических веществ. Все арены горят
коптящим пламенем ввиду высокого содержания углерода в их
молекулах.
Физические свойства некоторых аренов
представлены в таблице.
Таблица. Физические свойства
некоторых аренов
Название
|
Формула
|
t°.пл.,
°C |
t°.кип.,
°C |
Бензол
|
C6H6
|
+5,5
|
80,1
|
Толуол (метилбензол)
|
С6Н5СH3
|
-95,0
|
110,6
|
Этилбензол
|
С6Н5С2H5
|
-95,0
|
136,2
|
Ксилол (диметилбензол)
|
С6Н4(СH3)2
|
||
орто-
|
-25,18
|
144,41
|
|
мета-
|
-47,87
|
139,10
|
|
пара-
|
13,26
|
138,35
|
|
Пропилбензол
|
С6Н5(CH2)2CH3
|
-99,0
|
159,20
|
Кумол (изопропилбензол)
|
C6H5CH(CH3)2
|
-96,0
|
152,39
|
Стирол (винилбензол)
|
С6Н5CH=СН2
|
-30,6
|
145,2
|
Бензол – легкокипящая (tкип = 80,1°С),
бесцветная жидкость, не растворяется в воде
Внимание!
Бензол – яд, действует на
почки, изменяет формулу крови (при длительном воздействии), может нарушать
структуру хромосом.
Большинство
ароматических углеводородов опасны для жизни, токсичны.
Химические свойства
бензола и его гомологов
Ароматическая система стремится сохранить свою стабильность даже в
результате химических превращений. Отсюда появляется особая устойчивость
ароматических систем, роднящая их с алканами. Несмотря на наличие существенной
степени ненасыщенности, ароматические соединения не вступают в реакции
присоединения, характерные для алкенов и алкинов. Вместо этого имеют место
реакции замещения, когда один или несколько атомов водорода при кольце
замещаются на другие атомы или группы атомов. Эти и другие реакции, протекающие
с бензоидными ароматическим соединениями, можно классифицировать следующим
образом.
Реакции ароматических соединений:
1. Реакции замещения в кольце:
• электрофильные,
• нуклеофильные.
2. Реакции в боковых радикалах:
• замещение,
• окисление,
• присоединение электрофильное.
3. Окисление кольца.
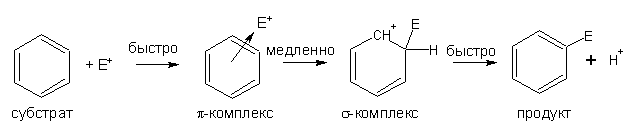
Электрофильное замещение в бензольном
кольце.
Общий механизм и энергетика реакций
Поскольку бензольное кольцо имеет облако электронной плотности над и под
плоскостью кольца, следует ожидать, что оно будет притягивать соединения и
частицы, имеющие полный положительный заряд или, как минимум, недостаток
электронной плотности. Такие реагенты называются электрофилами. Их
схематическое обозначение, применяемое наиболее часто, Е+.
Хотя повторимся, с ароматическим кольцом способны реагировать и нейтральные
молекулы, имеющие центры дефицита электронной плотности (например, серный
ангидрид).
Наиболее
типичная схема реакции ароматического электрофильного замещения:
Энергетический профиль реакции электрофильного замещения (Еа –
энергия активации соответствующей стадии).
Реакции электрофильного замещения бывают необратимые и обратимые. На
рисунке показана энергетическая схема, характерная для необратимой реакции.
Энергетическая схема обратимой реакции отличается тем, что максимумы (между
энергией сигма-комплекса) примерно одинаковы по величине.
Среди реакций замещения рассмотрим реакции нитрования, галогенирования,
сульфирования, алкилирования и ацилирования. Замещаемой частицей во всех
случаях является протон (Н+).
Реакции различаются лишь способом образования активной частицы реакции – электрофила Е+.
Нитрование
HO-NO2 + H2SO4 → H2O + NO2+ + HSO4-.
B
качестве нитрующих агентов используются системы, в которых генерируется +NO2,
либо соединение общей формулы NO2-Y, где Y – хорошая уходящая
группа.
На
примере реакции нитрования алкилбензолов отчетливо прослеживается влияние
пространственных факторов на направление электрофильного замещения. Так, при
нитровании толуола (метилбензола) орто-изомер образуется в качестве основного
продукта, а при переходе к этил-, изо-пропил- и особенно к трет-бутил-бензолу
его выход существенно уменьшается.
Применение
нитросоединений. Нитрогруппа может быть легко восстановлена в аминогруппу, а
далее замещена (через диазосоединения) на водород, галоген и любую другую (в
том числе – трудно входящую) группу.
Сульфирование
HO-SO3H + H-SO4H → HSO3+ + HSO4-.
В качестве сульфирующей частицы может выступать также и свободный
триоксид серы, электрофильным центром является сильно поляризованный атом серы:
Сульфирование является обратимым процессом (удаление водяным паром).
Для предотвращения процесса десульфирования применяют олеум
(связывает образующуюся в процессе сульфирования воду).
Сульфирующие агенты:
1)серная кислота или олеум (20–25 % или 60–65 %, олеум
от 30 до 60 % – твердое вещество, потому неудобен для применения);
2)хлорсульфоновая кислота;
3)триоксид серы;
4)пиридинсульфотриоксид (комплекс пиридина и серного ангидрида).
Пи сульфирования
(π): концентрация
серного ангидрида, при достижении которой реакция сульфирования прекращается.
Величина π сульфирования зависит от температуры и
типа сульфируемого соединения.
Температурный режим сульфирования: с ростом температуры появляются продукты
полисульфирования, сульфоны, иногда окисляется субстрат. Меняется состав
продуктов:
сульфирование фенола на холоду дает 2-фенолсульфокислоту, а при
100 °С – 4-фенолсульфокислоту;
нафталин при 55–60 °С дает 1-нафталинсульфокислоту, а при
160 °С – 2-нафталинсульфокислоту;
сульфирование бензола: при реакции с моногидратом серной кислоты при 50–60 °С
получаются продукты с одной сульфогруппой в кольце (бензолсульфокислота). Мета-
бензолдисульфокислота получается при сульфировании бензола 65 % олеумом
при 80–90 °С или при реакции бензолсульфокислоты с ним же при
30–80 °С.
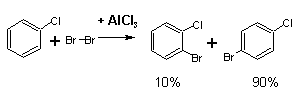
Галогенирование
В отличие от нитрования, при галогенировании атака ароматического
субстрата может осуществляться различными электрофилами. Галогенирование – реакция экзотермическая. В процессе галогенирования в
промышленности применяется охлаждение (во избежание получения продуктов
полигалогенирования). Температура процесса для получения моногалогензамещенного
бензола – 20–70 °С.
Катализаторы:
железные опилки (1 % от массы хлорируемого продукта), хлорное железо
(0,5 %) или qод (0,1 %). Толуол хлорируется в ядро в присутствии SbCl3 (0,23 %).
Свободные галогены могут легко атаковать активированное ароматическое ядро (например, фенола), в других случаях
требуется катализатор (Cl2 + AlCl3 → Cl+ + AlCl4-):
Галогенирование протекает очень энергично, если использовать
реагенты, в которых галоген в результате поляризации имеет сильный
положительный заряд или даже существует как катион. Так, очень инертный
мета-динитробензол можно пробромировать бромом в концентрированной серной
кислоте в присутствии сульфата серебра. Предполагают, что в этом случае
промежуточно образуется бром-катион:
2Br2 + Ag2SO4 → 2Br+ + 2AgBr + SO42-
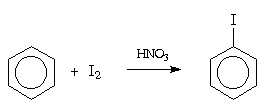
Реакционная способность элементарного йода в реакциях электрофильного
замещения в ароматическом ядре незначительна, так что прямое йодирование
возможно только в случае фенола и ароматических аминов. Йодирование других
ароматических соединений проводят в присутствии окислителя (обычно, азотной
кислоты). Считается, что в этих условиях роль электрофильного агента играет
ион: (J2 + NO+2 → J+ + JNO2):
Для галогенирования аренов можно применять также смешанные галогены,
например, монохлорид брома (BrCl) или йода (ICl):
Более селективное галогенирование достигается более устойчивыми
(стабильными) электрофилами.
Скорости реакции галогенпроизводных бензола и ориентация замещения.
+М-эффект фтора больше, чем у других галоидов. Скорости реакций нитрования
фтор-, хлор- и бромбензолов соотносятся как 5:1,1:1 (Ингольд). Однако при
ориентации в орто-положение преимущество имеет хлор (Н.Н. Ворожцов-мл.):
Бромирование. Из-за дороговизны брома в промышленности применяется редко. Отходящая HBr
регенерируется в элементарный бром при реакции с хлором:
2 HBr + Cl2 →
2 HCl + Br2.
Бром для бромирования можно регенерировать в процессе воздействия хлора на
смесь бромида и бромата натрия:
6ArH + NaBrO3 + 5 NaBr + 3 Cl2 →
6 ArBr + 6NaCl + 3 H2O.
Свойства и применение галогенпроизводных
бензола
Дипольные моменты. Вследствие наличия двух противоположно направленных
электронных эффектов (+М и –I) дипольные моменты арил- и винилгалогенидов
существенно меньше, чем у алкилгалогенидов. Это значит, что менее
поляризованная связь углерод-галоген упрочняется и в целом соединение более
стабильно, то есть галоген в составе арил- и винилгалогенидов химически инертен
и не склонен к легкому отщеплению.
Алкилирование по Фриделю–Крафтсу
1. Алкилирование алкилгалогенидами:
CH3-CH2-Cl + AlCl3 → CH3-CH2+ + AlCl4-.
2. Алкилирование алкенами:
CH2=CH2 + H+ → CH3-CH2+.
3. Алкилирование спиртами:
CH3-CH2-OH + H+ → CH3-CH2+ + H2O.
4. Алкилирование алкенами в присутствии кислоты Льюиса в качестве катализатора:
Алкилирование по Фриделю–Крафтсу имеет ограниченное применение в лаборатории,
так как обычно при этой реакции образуются смеси продуктов, что обусловлено
рядом причин:
1) полиалкилирование,
2) обратимость,
3) изомеризация карбкатионов,
4) образование м-изомеров.
Например, в реакции алкилирования по Фриделю–Крафтсу, особенно при
проведении реакции при повышенной температуре, часто образуется не смесь орто-,
пара-изомеров, а преимущественно мета-изомер.
Ацилирование по
Фриделю–Крафтсу
В качестве реагентов ацилирования используются галогенангидриды и
ангидриды кислот:
Электрофильная активность этих соединений, однако, невелика, и
должна быть повышена действием кислот Льюиса (AlCl3).
СH3-CO-Cl + AlCl3 → CH3-CO+ + AlCl4-.
При этом кислотный катализатор, как правило, атакует атом
кислорода карбонильного соединения и, смещая электронную плотность, повышает
положительный заряд соседнего атома углерода. В результате образуется
поляризованный комплекс (а в пределе – ацилкатион), действующий как электрофил:
Если при алкилировании расходуются каталитические количества AlCl3, то при ацилировании – минимум 2 моля: комплекс с реагентом + комплекс с продуктом + комплекс с
кислотой (если используется ангидрид).
По окончании реакции образовавшийся комплекс кетона с хлоридом
алюминия должен быть гидролитически разрушен (соляной кислотой со льдом).
Полиацилирования не наблюдается, поскольку образующийся кетон
значительно менее реакционноспособен, чем исходное соединение. Поэтому
алкилбензолы часто предпочитают получать не прямым алкилированием, а
ацилированием по Фриделю–Крафтсу с последующим восстановлением. Ароматические
соединения сдезактивирующими заместителями (заместителями II рода), например, нитро- или циано-группами, также не ацилируются по Фриделю–Крафтсу.
Возможными побочными реакциями ацилирования являются реакции алкилирования, если используется
ацилгалогенид с разветвленным углеводородным радикалом. Такие ацил-катионы
(особенно в разбавленных растворах) легко отщепляют окись углерода с
образованием стабильного карбкатиона:
Получение аренов (бензола
и его гомологов)
В лаборатории
1. Сплавление солей бензойной
кислоты с твёрдыми щелочами
C6H5-COONa
+ NaOH t → C6H6 +
Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5-R + 2NaГ
С6H5-Cl + 2Na + CH3-Cl → C6H5-CH3 +
2NaCl
В промышленности
·
выделяют из
нефти и угля методом фракционной перегонки, риформингом;
·
из
каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с
числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2
2. Тримеризация ацетилена (только
для бензола) – р. Зелинского:
3С2H2 600°C, акт. уголь → C6H6
3. Дегидрированием циклогексана
и его гомологов:
Советский академик Николай Дмитриевич Зелинский
установил, что бензол образуется из циклогексана (дегидрирование
циклоалканов
C6H12 t,
kat→ C6H6 + 3H2
C6H11-CH3 t, kat→ C6H5-CH3 +
3H2
метилциклогексан толуол
4. Алкилирование бензола (получение
гомологов бензола) – р Фриделя-Крафтса.
C6H6 +
C2H5-Cl t,
AlCl3→ C6H5-C2H5 +
HCl
хлорэтан этилбензол
Применение бензола и его гомологов
Бензол C6H6 – хороший
растворитель. Бензол в качестве добавки улучшает качество моторного топлива.
Служит сырьем для получения многих ароматических органических соединений –
нитробензола C6H5NO2 (растворитель, из него получают анилин), хлорбензола C6H5Cl,
фенола C6H5OH, стирола и т.д.
Толуол C6H5–CH3 –
растворитель, используется при производстве красителей, лекарственных и
взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2.
Технический ксилол – смесь трех изомеров (орто-, мета- и пара-ксилолов) –
применяется в качестве растворителя и исходного продукта для синтеза многих
органических соединений.
Изопропилбензол C6H5–CH(CH3)2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения
в бензоле атомов Н атомами хлора – гексахлорбензол С6Сl6 –
фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против
твердой головни. Продукт присоединения хлора к бензолу –
гексахлорциклогексан (гексахлоран) С6Н6Сl6 –
инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества
относятся к пестицидам – химическим средствам борьбы с микроорганизмами,
растениями и животными.
Стирол C6H5 – CH = CH2 очень легко полимеризуется, образуя полистирол, а
сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
УПРАЖНЕНИЯ
1. Из 7,8 г бензола
получено 8,61 г нитробензола. Определите выход продукта реакции.
Решение:
Ответ: 70%
__________________________________________________________________
Решение:
Ответ: 70%
__________________________________________________________________
2. Технический карбид кальция массой 20 г обработали избытком воды. Какой объем ацетилена получили, если массовая доля примесей техническом карбиде составляла 20 %.
Решение:
Ответ: 5,6 л
__________________________________________________________________
3.
__________________________________________________________________
4.
__________________________________________________________________
5.
__________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Напишите структурные формулы и
назовите изомерные ароматические углеводороды состава: а) С8Н10;
б) С9Н12.
2. Напишите структурные формулы и
назовите по номенклатуре ИЮПАК следующие ароматические углеводороды: а)
м-ксилол; б) п-дипропилбензол; в) о-бутилтолуол; г) кумол; д)
симм-тетраметилбензол (дурол).
3. Есть ли среди перечисленных
соединений одинаковые? Для решения вопроса назовите каждое соединение по
номенклатуре ИЮПАК.
4. Назовите соединения по номенклатуре
ИЮПАК.
5. Среди нижеперечисленных укажите
соединения, обладающие ароматическими свойствами.
6. Среди нижеперечисленных укажите
соединения, обладающие антиароматическими свойствами.
7. Какие из показанных в задачах 4 и 5
соединений являются неароматическими?
8. При окислении 92 г толуола
получено 116 г бензойной кислоты. Рассчитайте выход продукта в % от
теоретического.
9. Что получится из н-пропилбензола
при обработке его хлором в присутствии хлористого алюминия? Напишите схему
реакции и назовите соединения.
10. Каково строение углеводорода С8Н10,
не обесцвечивающего бромную воду, а при окислении образующего бензойную
кислоту? Назовите его по номенклатуре ИЮПАК.
ВИДЕО ОПЫТ
1.
Число изомерных диметилпроизводных бензола равно:
|
|
а) изомеров нет
|
б) 2
|
в) 4
|
г) 3
|
2.
Толуол можно получить:
|
|
а) дегидрированием метилциклогексана
|
б) дегидрированием гексана
|
в) гидрированием метилциклогексана
|
г) тримеризацией ацетилена
|
3.
Бензол может быть превращен в циклогексан
реакцией:
|
|
а) гидрирования
|
б) дегидрирования
|
в) гидратации
|
г) дегидратации
|
4.
Укажите значение молярной массы гомолога бензола
(г/моль), в молекуле которого содержится 7 атомов углерода:
|
|
а) 98
|
б) 96
|
в) 100
|
г) 92
|
5.
При каких условиях из бензола образуется
хлорбензол:
|
|
а) действием НСl
|
б) действием Сl2 при
освещении ультрафиолетовым светом
|
в) при обработке хлором в присутствии FeCl3
|
г) действием NaCl
|
6.
Укажите число изомерных трихлорбензолов:
|
|
а) 2
|
б) 3
|
в) 4
|
г) 5
|
7.
При каких условиях из бензола образуется
нитробензол:
|
|
а) при действии KNO3
|
б) при действии KNO2
|
в) при действии HNO2
|
г) при действии HNO3/H2SO4
|
8.
Назовите продукт, образующийся при взаимодействии
бензола и смеси азотной и серной кислот:
|
|
а) нитробензол
|
б) бензолсульфокислота
|
в) циклогексан
|
г) ацетилен
|
9.
Укажите число возможных изомеров с молекулярной
формулой С3Н4:
|
|
а) 1
|
б) 2
|
в) 3
|
г) 4
|
10.
Укажите
число возможных изомеров с молекулярной формулой С4Н6:
|
|
а) 4
|
б) 5
|
в) 6
|
г) 7
|
Ответы:
1
|
г
|
2
|
а
|
3
|
а
|
4
|
г
|
5
|
в
|
6
|
б
|
7
|
г
|
8
|
а
|
9
|
в
|
10
|
г
|





































Комментариев нет:
Отправить комментарий