9.7. Алкины (ацетиленовые УВ)
Алкины – это алифатические
(ациклические), непредельные (ненасыщенные) углеводороды, с одной тройной
углерод-углеродной связью С≡С в цепи и общей формулойСnH2n-2
Строение
Ацетилен –
первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н
Алкины –
углеводороды, содержащие тройную связь С=С, углероды при которой находятся в
sp-гибридизованном состоянии. Схема sp-гибридизации орбиталей атома углерода:
Пространственная
конфигурация молекулярных орбиталей атома углерода в алкинах:
Тройная
связь образована перекрыванием двух sp-гибридизованных орбиталей (от каждого из
углеродов) и четырех негибридизованных р-орбиталей (по две от каждого
углерода). Две негибридизованные р-орбитали у каждого из углеродов расположены
во взаимно перпендикулярных плоскостях:
На рисунке изображена орбитальная
модель молекулы ацетилена.
Запомните!
1.
Длина связи 0,12 нм
2.
Угол 180
3.
Линейная молекула
4.
Связи – σ и 2π
5. Sp-
гибридизация
|
Физические
свойства
С2Н2 –
Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом
виде почти без запаха.
Свойства гомологов изменяются
аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы.
Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В
обычных условиях алкины С2–С3 – газы, С4–С16 –
жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи
приводит к повышению температуры кипения, плотности и растворимости их в воде
по сравнению с олефинами и парафинами.
Физические свойства некоторых
алкинов сведены в таблице.
Таблица. Физические свойства некоторых алкинов
Название
(Суффикс –ин)
|
Формула
|
t°пл.,
°C |
t°кип.,
°C |
Этин
(Ацетилен)
|
HC≡CH
|
-80,8
|
-83,6
|
Пропин
(Метилацетилен)
|
CH3–C≡CH
|
-102,7
|
-23,3
|
Бутин-1
|
C2H5–C≡CH
|
-122,5
|
8,5
|
Бутин-2
|
CH3–C≡C–CH3
|
-32,3
|
27,0
|
Пентин-1
|
CH3–CH2–CH2–C≡CH
|
-98,0
|
39,7
|
Пентин-2
|
CH3–CH2–C≡C–CH3
|
-101,0
|
56,1
|
Изомерия
и номенклатура
Структурная изомерия
1. Изомерия
положения тройной связи (начиная с С4Н6):
2. 2.
Изомерия углеродного скелета (начиная с С5Н8):
3. Межклассовая
изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:
Пространственная изомерия относительно тройной связи в
алкинах не проявляется, т.к. заместители могут располагаться только одним
способом - вдоль линии связи.
Химические
свойства алкинов
I. Реакции
присоединения
1). Галогенирование – стадийно, до производных
алканов:
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2-CHBr2 (1,1,2,2-тетрабромэтан)
2). Гидрогалогенирование
(труднее, чем у алкенов) – стадийно:
* CH3-C≡CH
+ HBr AlBr3→ CH3-CBr=CH2
2-бромпропен
* - используется пр. Марковникова
3). Гидратация – ( р. М.Г. Кучерова)
CH≡CH + H2O Hg2+,H+→ [CH2=CH-OH] → CH3-CH=O
(уксусный альдегид )
непредельный спирт
– енол
протекает в присутствии солей ртути(II) – HgSO4,
Hg(NO3)2 – с образованием уксусного альдегида:
Эта реакция носит имя русского ученого Михаила
Григорьевича Кучерова (1881).
4).
Полимеризация
В
определенных условиях ацетилен способен полимеризоваться в бензол и
винилацетилен.
1. При пропускании ацетилена над активированным углем при
450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl ацетилен
димеризуется, образуя винилацетилен:
Винилацетилен обладает большой реакционной
способностью; присоединяя хлороводород, он образует хлоропрен, используемый для
получения искусственного каучука:
II. Реакции окисления и восстановления
1). Горение – пламя сильно коптящее
CnH2n-2 + (3n-1)/2O2 t → nCO2 +
(n-1)H2O + Q
2). Окисление
Протекание реакции и её продукты
определяются средой!
А) в кислой среде при
нагревании образуются
карбоновые кислоты, при концевой кратной связи - CO2:
5CH3 – CH2 – C ≡ C – CH3 +
6KMnO4 + 9H2SO4 → 5CH3 –
CH2COOH + 5CH3COOH + 6MnSO4 + 3K2SO4 +
4H2O
5CH3 – C ≡ CH + 8KMnO4 + 12H2SO4 → 5CO2 +
5CH3COOH + 8MnSO4 + 4K2SO4+12H2O
Б) в нейтральной и
слабощелочной средах на холоде образуются соли карбоновых кислот;
ацетилен окисляется до оксалатов (солей щавелевой кислоты):
3CH ≡ CH + 8KMnO4 →
3KOOC – COOK + 8MnO2 + 2KOH + 2H2O
CH3 – C ≡ C – CH3 + 2KMnO4 → 2CH3 –
COOK + 2MnO2
3CH ≡ C – CH3 + 8KMnO4 → 3CH3 –
COOK + 2K2CO3 + KHCO3 + 8MnO2 +
H2O
3). Восстановление ( kat – Ni,Pd или Pt)
C2H2 + H2 t,kat→ C2H4
C2H2 + 2H2 t,kat→ C2H6
III. Реакции замещения
1). Кислотные свойства
(в отличие от алкенов,
образуют соли – ацетилениды)
R-C≡C-H + NaH → R-C≡C-Na + H2↑
Качественные реакции на алкины с
тройной связью в конце цепи
R-C≡CH + [Ag(NH3)2]OH → R-C≡C-Ag↓ +2NH3 + H2O
серо-белый
осадок
R-C≡C-H + [Cu(NH3)2]Cl → R-C≡C-Cu↓ + NH4Cl +NH3
красный
осадок
Ацетилениды серебра и меди (I)-
разлагаются соляной кислотой:
R-C≡C-Cu↓ +HCl → R-C≡C-H + CuCl
Ацетилениды металлов – взрывчатые
вещества!
Получение
1. Термическое
разложение алканов (электрокрекинг)
2CH4 t=1500→ HC≡CH + 3H2 (пиролиз метана)
C2H6 t,kat → C2H2 +
2H2 (t=1200)
2C3H8 t,kat → 3C2H2 +
5H2 (t=1200)
2. Гидролиз карбида
кальция
В лаборатории и в промышленности
ацетилен получают взаимодействием карбида кальция с водой (карбидный
способ): CaC2 + 2H2O → Ca(OH)2 + C2H2
Карбид кальция получают в
электропечах при нагревании кокса с негашеной известью:
3. Дегидрогалогенирование дигалогеналканов:
4. Из
ацетиленидов
HC≡CMe + R-Г → HC≡C-R + MeГ
HC≡CNa + CH3-Cl → HC≡C-CH3 +
NaCl
моноацетиленид пропин
натрия
MeC≡CMe + 2R-Г → R-C≡C-R + 2MeГ
AgC≡CAg + 2CH3-I (йодметан)→ CH3-C≡C-CH3 (бутин-2)+ 2AgI↓
ацетиленид
серебра
Применение
Ацетилен широко применяют в
органическом синтезе. Он является одним из исходных веществ при производстве
синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена
получают уксусную кислоту, растворители (1,1,2,2-тетрахлорэтан и
1,1,2-трихлорэтен). При сжигании ацетилена в кислороде температура пламени
достигает 3150 °С, поэтому его используют при сварке и резке металлов.
Примеры промышленного использования
ацетилена:
УПРАЖНЕНИЯ
1. Напишите структурные формулы изомерных ацетиленовых углеводородов
состава С7Н12, главная цепь которых состоит из пяти
углеродных атомов, и назовите их.
Решение:
Тройная связь в главной цепи может находиться
в положениях 1 и 2:
С – С – С – С ≡
С С – С – О ≡ С — С
В первом случае возможны четыре
структурных изомера (две группы -СН3 в положениях 3,3; 3,4; 4,4
или одна группа -С2Н5 в положении 3):
3,3-диметилпентин-1 4,4-диметилпентин-1
3.4-диметилпентин-1
3-этилпентин-1
Во втором случае возможен
единственный изомер, когда две метильные группы находятся в положении 4:
4,4-диметилпентин-2
Ответ. 5 изомеров.
__________________________________________________________________
2. При пропускании смеси пропана и ацетилена через склянку с бромной водой
масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества
исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси.
Решение:
Ацетилен поглощается бромной водой:
НC ≡ СH + 2Вr2 →
НСВr2 -СНВr2 .
1,3 г — это масса ацетилена. v(C2H2) = 1,3/26 = 0,05 моль. При сгорании
этого количества ацетилена по уравнению
2С2Н2 +
5О2 = 4СО2 + 2Н2О
выделилось 2-0,05 = 0,1 моль СО2.
Общее количество СО2 равно 14/22,4 = 0,625 моль. При сгорании
пропана по уравнению
С3Н8 + 5О2 =
ЗСO2 + 4Н2О
выделилось 0,625 — 0,1 = 0,525
моль СО2, при этом в реакцию вступило 0,525/3 = 0,175 моль С3Н8 массой
0,175 — 44 = 7,7 г.
Общая масса смеси углеводородов
равна 1,3+7,7 = 9,0 г, а массовая доля пропана составляет: w(С3Н8)
= 7,7/9,0 = 0,856, или 85,6%.
Ответ. 85,6% пропана.
__________________________________________________________________
3. Как химическим путем выделить бутин-2 из его смеси с бутином-1?
Решение:
Смесь следует пропустить через
аммиачный раствор оксида серебра. При этом бутин-1 поглотится за счет реакции
СН3 — СН2 —
С ≡СН + [Ag(NH3)2]OH → CH3 — CH2 —
C ≡CAg↓ + 2NH3 + Н2О.
Бутин-2 не реагирует с [Ag(NH3)2]OH и
улетучится в чистом виде.
__________________________________________________________________
4. Эквимолярная смесь ацетилена и формальдегида полностью прореагировала с
69,6 г оксида серебра (аммиачный раствор). Определите состав смеси (в % по
массе).
Решение:
Оксид серебра реагирует с обоими
веществами в смеси:
НС ≡ СН + Аg2О → AgC ≡ CAg↓ + Н2О,
СН2О + 2Аg2О → 4Аg↓ + СО2 + Н2О.
(Уравнения реакции записаны в
упрощенном виде).
Пусть в смеси содержалось по х моль
С2Н2 и СН2О. Эта смесь прореагировала с
69,6 г оксида серебра, что составляет 69,6/232 = 0,3 моль. В первую реакцию
вступило х моль Аg2О, во вторую — 2х моль Аg2О, всего — 0,3 моль, откуда следует,
что х = 0,1.
m(C2H2) = 0,1 — 26 = 2,6 г; m(CH2O) = 0,1-30 =
3,0 г; общая масса смеси равна 2,6+3,0 = 5,6 г. Массовые доли компонентов в
смеси равны: w(С2Н2) = 2,6/5,6 = 0,464, или
46,4%; w(СН2О) = 3,0/5,6 = 0,536, или 53,6%.
Ответ. 46,4% ацетилена, 53,4%
формальдегида.
__________________________________________________________________
5. Дихлоралкан, в котором атомы хлора находятся у соседних атомов углерода,
обработали избытком спиртового раствора щелочи. Масса выделившегося газа
оказалась в 2,825 раза меньше массы исходного дихлоралкана. Установите строение
исходного соединения и продукта реакции.
Решение:
При обработке дихлоралкана избытком
спиртового раствора щелочи отщепляются две молекулы хлороводорода и образуется
алкин:
С2Н5ОН
CnH2nCl2 + 2KOH
→ CnH2n-2↑ + 2KCl + 2Н2О.
Согласно уравнению реакции, из 1
моль СnН2nСl2 массой (14n + 71) г
выделяется 1 моль СnН2n-2 массой (14n-2) г. По
условию,
(14n — 2) • 2,825 = 14n + 71,
откуда n = 3. Искомый алкин — пропин,
СН3 – С ≡ СН, он образуется из 1,2-дихлорпропана:
С2Н5ОН
|
||
СН3СНСl — СН2Сl +
2КОН
|
→
|
CH3C ≡ CH ↑ + 2KCl + 2Н2О
|
Ответ. 1,2-дихлорпропан;
пропин.
__________________________________________________________________
6.
__________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Что получится при реакции
2,2-дихлорбутана со спиртовым раствором КОН при нагревании? Напишите уравнения
реакции и назовите соединения по рациональной и ИЮПАК номенклатурам.
2. Что получится при реакции
1,2-дибромбутана со спиртовым раствором КОН при нагревании? Напишите уравнения
реакции и назовите соединения по рациональной и ИЮПАК номенклатурам.
3. Что получится при реакции
2,2,3,3-тетрахлорбутана с цинковой пылью? Напишите уравнения реакции и назовите
соединения по рациональной и ИЮПАК номенклатурам.
4. Какие дигалогенпроизводные
нужно взять в качестве исходных веществ для получения следующих углеводородов:
а) метилацетилена; б) диметилацетилена; в) гексина-2? Напишите уравнения
реакций и назовите соединения по рациональной и ИЮПАК номенклатурам.
5. Сколько миллилитров воды
потребуется для разложения 25 г 80%-ного карбида кальция? Каков объем
образующегося при этом ацетилена (при нормальных условиях)?
6. Какой углеводород
получится, если на 4,4-диметилпентен-2 подействовать бромом и полученное
соединение обработать спиртовым раствором щелочи при нагревании? Напишите
уравнения реакций и назовите соединения по рациональной и ИЮПАК номенклатурам.
7. Каким образом (с помощью
раствора аммиачного комплекса окиси серебра [Ag(NH3)2]OH)
можно отличить бутин-1 от бутина-2? Напишите уравнения реакций, которые пойдут.
8. Назовите алкин, образующий
с бромистым водородом 2,2-дибром-3-метилбутан.
9. Напишите реакцию
гидратации по Кучерову бутина-1 и назовите продукт
10. На метилацетилен
подействовали последовательно амидом натрия (NaNH2), бромистым
этилом (СН3-СН2-Br) и полученное соединение обработали
избытком бромистого водорода. Напишите схемы всех реакций и назовите полученные
и промежуточные соединения.
ВИДЕО ОПЫТ
1.
При взаимодействии между собой трех молекул
ацетилена в присутствии катализатора и при нагревании получается:
|
|
а) бензол
|
б) винилацетилен
|
в) винилхлорид
|
г)
изопрен
|
2.
В результате димеризации ацетилена в присутствии
катализатора образуется:
|
|
а) ацетальдегид
|
б) 1,3-бутадиен
|
в) винилацетилен
|
г) бензол
|
3.
По реакции Кучерова получают:
|
|
а) из этанола 1,3-бутадиен
|
б) из ацетилена винилацетилен
|
в) из ацетилена ацетальдегид
|
г) из хлорэтана этан
|
4.
В молекуле какого вещества длина связи между
атомами углерода наименьшая:
|
|
а) пропан
|
б) этен
|
в) этин
|
г) этан
|
5.
В молекуле алкина 8 атомов углерода. Укажите
значение молярной массы алкина (г/моль):
|
|
а) 110
|
б) 112
|
в) 114
|
г) 108
|
6.
Соединение, которое преимущественно получается при
взаимодействии 1 моль пропина и 1 моль бромоводорода, называется:
|
|
а) 1-бромпропен
|
б) 2-бромпропен
|
в) 1,2-дибромпропен
|
г) все указанные ответы неверны
|
7.
Как изменяется массовая доля углерода в алкинах с
возрастанием молярной массы алкина:
|
|
а) уменьшается
|
б) возрастает
|
в) не изменяется
|
г) все указанные ответы неверны
|
8.
Величина относительной молекулярной массы алкина
равна 82. Число атомов водорода в молекуле алкина составляет:
|
|
а) 6
|
б) 10
|
в) 16
|
г) 12
|
9.
С каким веществом реагируют как пропан, так и
пропин:
|
|
а) водородом
|
б) бромной водой
|
в) кислородом
|
г) водой
|
10.
Укажите число изомерных алкинов состава С5Н8:
|
|
а) 2
|
б) 3
|
в) 4
|
г) 5
|
Ответы:
1
|
а
|
2
|
в
|
3
|
в
|
4
|
в
|
5
|
а
|
6
|
б
|
7
|
а
|
8
|
б
|
9
|
в
|
10
|
б
|










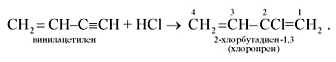






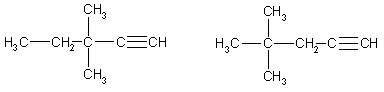



Комментариев нет:
Отправить комментарий