2.7. Закон
Авогадро. Молярный объем и относительные плотности газов. Уравнение Клапейрона
– Менделеева
В
газообразном состоянии расстояния между частицами вещества намного больше, чем
в жидком и твердом агрегатных состояниях. Эти расстояния намного больше
размеров молекул данного газа. Поэтому объем газа определяется не размером его
молекул, а расстояниями между ними. Эти расстояния зависят от внешних условий:
температуры и давления. При одинаковых внешних условиях расстояния между
молекулами различных газов одинаковы, поэтому:
В равных объемах
(V) различных газов при одинаковых внешних условиях (температуре Т и давлении
Р) содержится одинаковое число молекул (N) (Закон
Авогадро, 1811 г.).
Например,
при одинаковых температуре и давлении в 1 л водорода
Н2 и 1 л кислорода О2
содержится одинаковое число молекул, хотя размер молекул кислорода намного
больше размера молекул водорода.
Первое следствие из закона Авогадро
Одинаковое число
молекул различных газов при одинаковых условиях занимает одинаковый объем:
Следовательно,
объем одного моля любого газа при
определенных внешних условиях есть величина постоянная.
Объем
одного моля газа называется его молярным
объемом и обозначается VМ.
Молярный
объем газа зависит от температуры и давления.
В
химии обычно используют молярный объем газа при нормальных условиях.
Молярный объем
любого газа при н.у. равен 22,4 л/моль.
Например,
2 г водорода Н2 (1 моль) и
32 г кислорода О2 (1 моль) занимают одинаковый объем, равный
22,4 л.
Зная
молярный объем газа VМ ,
можно рассчитать объем V любого количества n и любой массы m газа:
Второе следствие из закона Авогадро
Второе
следствие используется для расчета относительных
плотностей газов.
Плотность
любого вещества p – это отношение
массы этого вещества m
к
его объему V:
Если
взять 1 моль любого газа, его масса равна молярной массе М, а объем равен молярному объему VМ.
Поэтому
плотность газа равна:
Возьмем
два газа – Х и Y – и обозначим их плотности и молярные массы соответственно p(Х), М(Х) и p(Y), М(Y).
Плотности этих газов равны:
Отношение
плотностей этих газов p(Х)/
p(Y) называется относительной плотностью газа Х по газу Y и
обозначается DY(X):
Таким
образом:
Относительная
плотность одного газа по другому газу равна отношению их молярных или
относительных молекулярных масс ( так как М и Мr численно равны):
Часто
плотности различных газов определяют по отношению к водороду, который является
самым легким из всех газов, и по отношению к воздуху.
Относительная
плотность любого газа Х по водороду равна:
Воздух
– это смесь газов, средняя относительная молекулярная масса воздуха равна 29.
Поэтому относительная плотность любого
газа Х по воздуху равна:
Относительные
плотности газов – величины безразмерные. Молекулярные (молярные) массы
неизвестных газов можно определять по относительным плотностям этих газов по
водороду или по воздуху:
В
расчетах, связанных с газами, часто приходится переходить от данных условий к
нормальным, или наоборот. При этом удобно пользоваться уравнением объединенного газового закона, выведенным французским
ученым Клапейроном и носящим его имя:
Из
этого уравнения можно рассчитать значение VН, если измерен объем газа
V при некоторых других условиях:
Соотношение
между давлением газа Р, его объемом V, количеством вещества (газа) n и
температурой Т описывается уравнением Клапейрона – Менделеева (уравнение
состояния идеального газа):
При
расчетах, связанных со смесями двух или нескольких газов, часто используют
понятие объемная доля газа в смеси,
которая обозначается буквой φ (фи):
Например,
объемные доли кислорода и азота в атмосферном воздухе равны приблизительно 21%
и 78% соответственно.
УПРАЖНЕНИЯ
1.
_____________________________________________________________
2.
_____________________________________________________________
3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Какой
объем при нормальных условиях занимают:
а) 20 г аргона; б) 7,1 г хлора.
2. Чему
равна масса: а) 1 л водорода; б) 1 л
кислорода.
3. Рассчитайте
относительные плотности по водороду и по воздуху следующих газов: а) метана СН4; б)
кислорода О2.
4. 10
г некоторого газа при н.у. занимают объем 5,6 л. Определите молярную и
относительную молекулярную массу этого газа.
5. Определите
молярную массу газа, относительная плотность которого: а) по водороду равна
32; б) по воздуху равна 2,45.
6. Сколько
молекул содержится в 1,00 мл водорода при нормальных условиях.
7. Какой
объем при н.у. занимают 27 * 1021 молекул газа.
8. На
вопрос, какой объем займет 1 моль воды при нормальных условиях, получен ответ:
22,4 л. Правильный ли это ответ.
9. Сколько
молекул углекислого газа находится в 1 л воздуха, если объемная доля СО2
составляет 0,03%.
10.
Определите объем, который занимают 0,07 кг азота N2
при 21оС и давлении 142 к Па.
|
1.
При н.у. 22,4 л – это объем:
|
|
|
а) 4 моль любого газа
|
б) одной молекулы любого газа
|
|
в) занимаемый 6,02 * 1023
молекулами газа
|
г) занимаемый неоном, массой 40 г
|
|
2.
При одинаковой массе и внешних условиях для
различных газов число молекул больше в том газе, для которого:
|
|
|
а) меньше значение молярной массы
|
б) больше значение молярной массы
|
|
в) нет верного ответа
|
г) меньше объем, занимаемый газом
|
|
3.
Для какого из оксидов азота плотность паров по
гелию равна 7,5:
|
|
|
а) NO
|
б) N2O
|
|
в) NO2
|
г) N2O5
|
|
4.
Для каких веществ объем 1 моль при н.у. равен 22,4
л:
|
|
|
а) вода
|
б) йод
|
|
в) алюминий
|
г) азот
|
|
5.
Чему равно число атомов в 5,6 л (н.у.) озона:
|
|
|
а) 1,51 * 1023
|
б) 3,01 * 1023
|
|
в) 4,52 * 1023
|
г) 6,02 * 1023
|
|
6.
Плотность паров серы по водороду при некоторых
условиях равна 32. Укажите формулу молекулы серы при этих условиях:
|
|
|
а) S8
|
б) S4
|
|
в) S2
|
г) S6
|
|
7.
Укажите единицу молярного объема:
|
|
|
а) моль/ л
|
б) г/ моль
|
|
в) л
|
г) л/ моль
|
|
8.
Масса молекулы некоторого газа равна 7,304*10-23
г. Чему равна относительная плотность этого газа по гелию:
|
|
|
а) 10
|
б) 11
|
|
в) 12
|
г) 13
|
|
9.
Для какого газа плотность при н.у. составляет 1,63 г/л:
|
|
|
а) оксид углерода (IV)
|
б) аммиака
|
|
в) хлороводорода
|
г) метана
|
|
10.
Плотность
газа по гелию равна 20. Чему равна масса молекулы газа:
|
|
|
а) 80 г/моль
|
б) 80 а.е.м.
|
|
в) 80 г
|
г) 80 кг
|
Ответы:
|
1
|
в
|
|
2
|
а
|
|
3
|
а
|
|
4
|
г
|
|
5
|
в
|
|
6
|
в
|
|
7
|
г
|
|
8
|
б
|
|
9
|
в
|
|
10
|
б
|















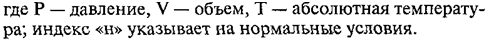









Комментариев нет:
Отправить комментарий