Раздел 8. Неметаллы и их неорганические соединения
8.1.
Общая характеристика неметаллов
Неметаллы –
это химические элементы, для атомов которых характерна способность, принимать
электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем
электронном слое 4-х и более электронов и малому радиусу атомов по сравнению с
атомами металлов.
Все элементы-неметаллы (кроме водорода) занимают в периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагонали B-At.
Все элементы-неметаллы (кроме водорода) занимают в периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагонали B-At.
Для неметаллов характерны высокие значения электроотрицательности, она изменяется в пределах от 2 до 4. неметаллы – это элементы главных подгрупп, преимущественно p-элементы, исключение составляет водород – s-элемент.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны.
В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличиваются в следующем порядке:
Все неметаллы, кроме
фтора, проявляют восстановительные свойства (способность отдавать электроны).
Причем эти свойства постепенно возрастают от кислорода к кремнию:
Положение неметаллических
элементов в периодической системе химических элементов
Группа
|
I
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
1-й период
|
Н
|
He
|
|||||
2-й период
|
В
|
С
|
N
|
O
|
F
|
Ne
|
|
3-й период
|
Si
|
P
|
S
|
CL
|
Ar
|
||
4-й период
|
As
|
Se
|
Br
|
Kr
|
|||
5-й период
|
Te
|
I
|
Xe
|
||||
6-й период
|
At
|
Rn
|
Как видно из таблицы, неметаллические
элементы в основном расположены в правой верхней части периодической системы.
В
электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как
правило, содержится от 4до 8 электронов. Исключение
составляют только водород H, у которого в электронной оболочке
атома вообще только один электрон, гелий He с двумя
электронами и бор B, у которого на наружнем энергетическом уровне
имеется три электрона.
Радиусы
атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу
близости положительно заряженного ядра атома, неметаллы хорошо удерживают свои
валентные электроны (электроны внешнего энергетического уровня).
Характер
изменения радиусов атомов химических элементов в периодах и в группах. Радиусы
атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся
в том же периоде.
Главное отличительное свойство неметаллов — это
их высокая электроотрицательность, т.е. способность в химических
соединениях притягивать электроны.
Величины
относительных электроотрицательностей (ОЭО) некоторых химических элементов (по
Л. Полингу). ОЭО неметаллических химических элементов (выделены красным
цветом) превосходит соответствующую величину металлических химических
элементов.
Атомы
неметаллов способны как принимать, так и отдавать электроны, а значит,
химические вещества, содержащие такие атомы, в ходе превращений могут выступать
как в роли окислителей, так и в роли восстановителей.
На внешнем
электронном слое у атомов неметаллов находится различное число электронов: у
атома водорода – один электрон (1s1), у атома гелия – два
электрона (1s2), у атома
бора – три элетрона (2s22p1). Однако атомы большинства
неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют
большое число электронов – от 4 до 8; их электронные конфигурации изменяются от
ns2np2 у атомов элементов главной подгруппы IV группы до ns2np6 у атомов инертных газов.
Положение неметаллов в периодической системе Д.И. Менделеева и электронные
конфигурации внешнего электронного слоя их атомов
Неметаллы
в природе
Из 118 известных на
данный момент химических элементов 96 являются металлическими и
только 22химических элемента относятся к неметаллическим.
Неметаллические
химические элементы широко распространены в земной коре.
Кислород и
кремний составляют около 76 % (практически три четверти) от
массы земной коры (O2 — 49,4 %, Si — 25,8 %).
Алюминий Al — 7,5%
Железо Fe — 4,7%
Кальций Ca — 3,4%
Натрий Na — 2,6%
Калий K — 2,4%
Магний Mg — 1,9%
Водород H — 0,9%
Титан Ti — 0,9%
Состав земной коры
Такие
химические элементы, как углерод C, водород H, кислород O,
азот N, фосфор P, и сера S составляют 98,5 % от
массы растений и 97,6 % от массы тела человека.
На долю
неметаллических химических элементов приходится большая часть массы живых
организмов.
В состав
земной атмосферы входят как простые, так и сложные вещества, образованные
элементами неметаллами.
В объёмных
долях на азот N2 приходится 78 %, на кислород O2 — 21 %,
а инертные газы составляют 0,96%от объёма воздуха. В
состав земной атмосферы также постоянно входит углекислый газ CO2,
доля которого (по разным оценкам) составляет около 0,04 % от
состава чистого воздуха.
Следует
иметь в виду, что в воздухе постоянно содержится водяной пар H2O и
другие соединения неметаллов, доля которых не является постоянной.
Неметаллические
химические элементы образуют большую часть веществ, входящих в состав
воздуха.
Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т.д. И на нашей планете из каждых 100 атомов, 17 — это атомы водорода.
Физические свойства
Простые вещества, образованные атомами неметаллов, построены с помощью
ковалентных неполярных связей.
Два типа строения простых веществ неметаллов:
Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (H2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8) и лишь бром (Br2) является жидкостью. Все эти вещества летучи, в твердом состоянии они легкоплавки, и способны к возгонке.
Атомное строение. Вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten) – имеют высокую твердость, высокие температуры кипения и плавления.
Многие элементы-неметаллы образуют несколько простых веществ – аллотропных модификаций.
Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы представляют собой диэлектрики. Кристаллы непластичны, а любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Два типа строения простых веществ неметаллов:
Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (H2, N2, O2, F2, Cl2, O3) или твердые вещества (I2, P4, S8) и лишь бром (Br2) является жидкостью. Все эти вещества летучи, в твердом состоянии они легкоплавки, и способны к возгонке.
Атомное строение. Вещества образованы длинными цепями атомов (Cn, Bn, Sin, Sen, Ten) – имеют высокую твердость, высокие температуры кипения и плавления.
Многие элементы-неметаллы образуют несколько простых веществ – аллотропных модификаций.
Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы представляют собой диэлектрики. Кристаллы непластичны, а любая деформация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Химические
свойства
1. Окислительные свойства
неметаллов
-
взаимодействие с металлами:
2Na + S = Na2S
- взаимодействие с водородом (образуются летучие водородные соединения):
H2 + Cl2 = 2HCl
- любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
2P + 3Cl2 = 2PCl3
- взаимодействие со сложными веществами:
CH4 + 2O2 = CO2 + 2H2O
2Na + S = Na2S
- взаимодействие с водородом (образуются летучие водородные соединения):
H2 + Cl2 = 2HCl
- любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение электроотрицательности:
2P + 3Cl2 = 2PCl3
- взаимодействие со сложными веществами:
CH4 + 2O2 = CO2 + 2H2O
2.
Восстановительные свойства
-
взаимодействие с кислородом (исключение – фтор):
4P + 5O2 = 2P2O5
- взаимодействие со сложными веществами-окислителями:
S + 6HNO3 = H2SO4 + 6NO2? + 2H2O.
При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2.
4P + 5O2 = 2P2O5
- взаимодействие со сложными веществами-окислителями:
S + 6HNO3 = H2SO4 + 6NO2? + 2H2O.
При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2.
3. Реакция
диспропорционирования
Характерна
для активных неметаллов. Протекает в щелочной среде:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O.
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O.
Взаимодействие неметаллов с металлами
УПРАЖНЕНИЯ
1.
Какой
объем хлороводорода может быть получен из 40 л хлора, если объемы
газов измерены при одинаковых условиях?
_________________________________________________________________
2. Какой объем оксида углерода (IV) (н. у.) получится
при разложении известняка массой 500 г, содержащего 20% примесей?
3. Запишите уравнения реакций, с помощью которых можно осуществить
превращения:
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Назовите
элементы шестой группы, которые относятся к неметаллам.
2.
Какие
элементы главной подгруппы четвертой группы относятся к неметаллам.
3.
Назовите
неметаллы, которые при обычных условиях являются газообразными веществами.
Какой неметалл при обычных условиях находится в жидком состоянии.
4.
Почему
элементы главной подгруппы восьмой группы называются инертными газами.
5.
Назовите все
неметаллы, атомы которых имеют конфигурацию внешнего слоя: ns2np5,
ns2np3.
6.
Укажите, в
каких из указанных ниже соединений атомы неметаллов имеют положительные степени
окисления:
7.
Запишите уравнения реакций, с помощью
которых можно осуществить следующие превращения:
S → SO2 → H2SO3 → Na2SO3 → SO2 → CaSO2.
8.
Напишите
химическую формулу каждого из следующих веществ: а) фторида ксенона (IV); б) оксида
азота (I), в) хлорида фосфора (V).
9.
Укажите в
каждой из указанных пар кислот более сильную кислоту:
.
10.
Напишите формулы кислот, образующихся при
взаимодействии воды со следующими кислотными оксидами:
.|
1.
При обычных
условиях из двухатомных молекул состоят:
|
|
|
а) гелий
и аргон
|
б) азот и неон
|
|
в) сера и фосфор
|
г) водород и кислород
|
|
2.
У атомов
химических элементов, расположенных в ряду: P-S-Cl, увеличивается:
|
|
|
а) радиус
|
б) окислительная способность
|
|
в) восстановительная способность
|
г) число неспаренных электронов
|
|
3.
Соединения
состава NaHЭO3 и NaHЭO4 может образовать:
|
|
|
а) углерод
|
б) сера
|
|
в) хлор
|
г) фосфор
|
|
4.
Наиболее
сильными кислотными свойствами обладает:
|
|
|
а) НСlО4
|
б) H2SO3
|
|
в) Н3РО4
|
г) H2SiО3
|
|
5.
Соединения
состава КЭО2 и КЭО3 образует элемент:
|
|
|
а) азот
|
б) фосфор
|
|
в) сера
|
г) марганец
|
|
6.
Водород
проявляет окислительные свойства при реакции с:
|
|
|
а) натрием
|
б) хлором
|
|
в) азотом
|
г) кислородом
|
|
7.
Способность
атомов химических элементов принимать
электроны усиливается в ряду:
|
|
|
а) F →O →N
|
б) N →F →0
|
|
в) N →O →F
|
г) O →N →F
|
|
8.
Сера проявляет
как окислительные, так и восстановительные свойства при взаимодействии с:
|
|
|
а) водородом и железом
|
б) углеродом и цинком
|
|
в) хлором и фтором
|
г) натрием и кислородом
|
|
9.
В ряду: Si →Р → S → Сl электроотрицательность элементов :
|
|
|
а) увеличивается
|
б) уменьшается
|
|
в) не
изменяется
|
г) сначала
уменьшается, потом увеличивается
|
|
10.
Водородное соединение состава Н2Э2 образует:
|
|
|
а) углерод
|
б) кремний
|
|
в) бор
|
г) азот
|
Ответы:
|
1
|
г
|
|
2
|
б
|
|
3
|
б
|
|
4
|
а
|
|
5
|
а
|
|
6
|
а
|
|
7
|
в
|
|
8
|
г
|
|
9
|
а
|
|
10
|
а
|

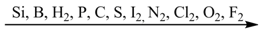
















Комментариев нет:
Отправить комментарий