9.4.
Понятие о циклоалканах
Циклоалканы
(алициклические углеводороды)
В составе циклических алканов углерод
также находится в состоянии sp3-гибридизации, однако степень
ненасыщенности там выше. Общая формула углеводородов ряда циклоалканов СnH2n.
(Не путать с алкенами, которые имеют такую же брутто-формулу.)
Классификация и
номенклатура
Циклоалканы различаются размером кольца, а
также количеством колец в молекуле.
Среди полициклоалканов существуют
соединения:
- с изолированными кольцами (А);
- с кольцами, соединенными простой связью
(В);
- кольцами, имеющими один общий атом
углерода (С);
- кольцами, имеющими два и более общих
атомов углерода (D):
А –
1-циклогексил-6-циклопропилгептан;
В –
1-метил-2-циклопентилциклогексан;
С – спиро[4,5]декан;
D –
2-метилбицикло[2.2.2]октан.
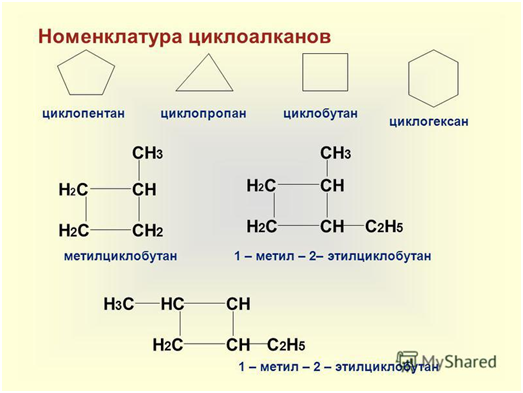
При наименовании моноциклических
соединений атомы углерода кольца нумеруются таким образом, чтобы сумма номеров
получилась минимальной, после чего перечисляются имеющиеся заместители и
добавляется название углеводорода, соответствующего числу атомов углерода в
кольце, с добавлением приставки цикло-:
Соединения, содержащие более одного цикла,
имеют более сложную систему наименований.
Так, если циклы изолированы (А), название формируется
от углеводорода с открытой цепью, а циклы выступают в роли заместителей.
Если циклы соединены простой связью, один из них
называется как радикал (В).
Если циклы имеют один общий атом углерода (вариант С),
такие молекулы называют спиранами, в квадратных скобках указывают количество
атомов углерода в одном и другом цикле, не считая общего атома. За скобками
следует название по общему числу атомов углерода в циклах, как если бы это была
незамкнутая цепь:
Полициклические углеводороды с кольцами,
имеющими два и более общих атома углерода, имеют также атомы углерода,
называемые головами мостов. Нумерация осуществляется от головы моста по пути
самого большого цикла, потом – меньшего цикла. Заместители перечисляются с
номерами атомов колец, к которым они присоединены, добавляется слово бицикло (для
бициклических углеводородов) или трицикло (для
трициклических). В квадратных скобках перечисляются числа атомов углерода в
мостах циклов, разделенные точкой, после чего добавляется название
углеводорода, соответствующее числу атомов углерода в циклах (суммарно):
Изомерия циклоалканов
Циклоалканы с одинаковым количеством атомов углерода в
молекуле могут иметь не только структурные изомеры (по размеру кольца и
расположению заместителей), но и пространственные изомеры, если кольцо имеет
при себе два и более заместителей.
Изомеры различаются расположением заместителей
относительно плоскости кольца.
На рисунке приведена проекционная модель
1,2-диметилциклогексана. Циклогексановое кольцо находится в конформации кресла.
(Красным и синим на рисунке показаны связи С-С кольца и заместителей. Черным –
связи с атомами водорода. Атомы водорода не показаны).
Видно, что в зависимости от положения метильных
заместителей относительно кольца возможно существование двух изомеров: когда
оба заместителя расположены с одной стороны кольца, и когда они располагаются
по разные стороны. На рисунке изображен транс-изомер 1,2-диметилциклогексана.
Конформации цикланов
Вследствие того, что нормальные валентные
углы sp3-гибридизованного углерода составляют чуть более 109°,
плоским может являться только кольцо циклопропана, где угловые напряжения
выражены очень сильно. Другие циклы далеки от состояния плоскости вследствие
того, что приспосабливаются к минимальным угловым напряжениям связей. Так,
например, циклогексан может находиться в двух конформационных состояниях –
«кресла» и «ванны»:
Эти состояния способны переходить друг в
друга и при обычной температуре, индивидуально разделимы быть не могут, поэтому
говорить о наличии изомеров тут не имеет смысла. Состояние «кресла»
энергетически более выгодно, особенно, если в положениях 1 и 4 имеются
заместители.
Химические свойства
циклоалканов
Химические свойства циклоалканов зависят
от величины цикла (до определенного размера). Малые циклы, вследствие сильного
углового напряжения, обладают повышенной внутренней энергией и склонны вступать
в реакции с раскрытием кольца. По мере снижения угловых напряжений (от
циклопропана к циклобутану) эта реакционная способность резко падает, а такие
соединения, как циклопентан или циклогексан, по химической способности сильно
напоминают алканы.
Так, соединения с числом атомов углерода в
цикле 7 и более ни по удельной теплоте гидрирования, ни по другим
характеристикам практически не отличаются от циклогексана.
Они не склонны вступать в реакции,
сопровождающиеся раскрытием кольца, для них также характерны реакции замещения,
протекающие по радикальному механизму.
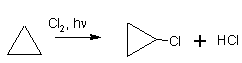
Так, для циклопропана (и в меньшей степени
– для циклобутана) характерны реакции:
При действии хлора наряду с разрывом цикла
идет также реакция замещения водорода:
Наличие в кольце электроноакцепторных
заместителей (-CN, -Cl, -NO2, -COOH и др.) размыкание циклов
затрудняет, а наличие электронодонорных (алкильные группы) – облегчает
раскрытие циклов.
Методы синтеза
циклоалканов
Действие металлического натрия на
1,3-дигалоидные производные алканов (внутримолекулярная реакция Вюрца):
Такое же превращение при действии цинковой
пыли в спиртовом растворе протекает даже лучше.
Важным способом получения трехчленных
циклов является также присоединение карбенов к непредельным соединениям:
Если применять для этой цели диазосоединения,
вначале образуются гетероциклы, которые при нагревании в присутствии меди
выделяют азот и образуют производные циклопропана:
Процессы дегидроциклизации нормальных и
разветвленных алканов приводят к получению 5- и 6-членных циклоалканов:
Получение циклов с большим количеством
атомов углерода оказалось неожиданно нетривиальной задачей. Во всяком случае,
указанными методами их получать не удается. Они были получены много позднее
различными косвенными путями.
УПРАЖНЕНИЯ
1.
При сгорании 10,5 г органического
вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды.
Плотность этого вещества при н.у. равна 1,875 г/л. Определите молекулярную
формулу вещества.
.
__________________________________________________________________
2. При
сгорании 112 л (н. у.) неизвестного циклоалкана в избытке кислорода образуется 336 л СО2.
Установите структурную формулу циклоалкана.
Решение:
Общая
формула гомологического ряда циклоалканов: СnH2n. При
полном сгорании циклоалканов, как и при горении любых углеводородов,
образуются углекислый газ и вода:
CnH2n + 1,5n O2 = n CO2 + n H2O.
Обратите
внимание: коэффициенты в уравнении реакции в данном случае зависят от n!
В
ходе реакции образовалось 336/22,4 = 15 моль углекислого газа. В реакцию
вступило 112/22,4 = 5 моль углеводорода.
Дальнейшие
рассуждения очевидны: если на 5 моль циклоалкана образуется 15 моль CO2,
то на 5 молекул углеводорода образуется 15 молекул углекислого газа, т. е.,
одна молекула циклоалкана дает 3 молекулы CO2. Поскольку каждая молекула
оксида углерода (IV) содержит по одному атому углерода, можно сделать вывод:
в одной молекуле циклоалкана содержится 3 атома углерода.
Вывод:
n = 3, формула циклоалкана - С3Н6.
Как
видите, решение этой задачи не "вписывается" в общий алгоритм. Мы не
искали здесь молярную массу соединения, не составляли никакого уравнения. В
этом примере присутствует еще одна "странность": необходимо найти
не только молекулярную, но и структурную формулу соединения. В предыдущей
задаче нам этого сделать не удалось, а в данном примере - пожалуйста! Дело в
том, что формуле С3Н6 соответствует
всего один изомер - циклопропан.
Ответ: циклопропан.
|
_____________________________________________________________
__________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Что такое циклоалканы и какова их общая формула.
2.
Назовите простейшие циклоалканы.
3.
Какие реакции возможны для циклоалканов в отличие от
алканов.
4.
Назовите способы получения циклоалканов.
5.
При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой
13,2 г и вода массой 5,85 г. Относительная плотность паров этого вещества по
воздуху равна 5,862. Определите формулу вещества.
6.
Написать
уравнения реакций, которые нужно провести для осуществления следующих
превращений: CH3COONa  CH4
CH4  CH3Br
CH3Br  C2H6
C2H6  CO2
CO2  CO
CO  CH4
CH4  C3H8.
C3H8.
7.
Привести
уравнения реакций получения и названия дигалогеналканов, необходимых для
получения следующих соединений: а)
1,2-диметилциклобутан; б)
пропилциклобутан; в) метилциклопропан.
8.
Органическое
вещество содержит 84,21% углерода и 15,79% водорода. Плотность паров вещества
по воздуху 3,93. Определить формулу вещества.
9.
Алкан имеет
плотность паров по воздуху 4,414. Определить формулу алкана.
10.
При сгорании 3,6
г алкана получили 5,6 л оксида углерода(IV) (н.у.). Какие объемы кислорода и
воздуха затратились на эту реакцию?
|
1.
Какая
связь характерна для алканов и циклоалканов:
|
|
|
а) ионная
|
б) ковалентная
неполярная
|
|
в) водородная
|
г) ковалентная
полярная
|
|
2.
Для циклогексана не характерна реакция:
|
|
|
а) присоединения
|
б) изомеризации
|
|
в) замещения
|
г) горения
|
|
3.
Сумма всех коэффициентов в уравнении реакции горения циклопропана
равна:
|
|
|
а) 11
|
б) 15
|
|
в) 23
|
г) 25
|
|
4.
При взаимодействии циклопропана с бромом образуется:
|
|
|
а) 1,3-дибромпропан
|
б) 1,1 - дибромпропан
|
|
в) бромциклопропан
|
г) 1.2-дибромциклопропан
|
|
5.
Циклоалканы при окислении образуют:
|
|
|
а) CO2 и H2O
|
б) спирты
|
|
в) двухатомные спирты
|
г) дикарбоновые кислоты
|
|
6.
С Хлороводородом НЕ реагирует:
|
|
|
а) циклопропан
|
б) циклобутан
|
|
в) циклопентан
|
г) метилциклопропан
|
|
7.
Для циклоалканов характерна изомерия:
|
|
|
а) структурная и межклассовая
|
б) структурная и цис-транс - изомерия
|
|
в) межклассовая и цис-транс - изомерия
|
г) положения функциональной группы и межкласовая
|
|
8.
Циклоалканы изомерны:
|
|
|
а) алканам
|
б) алкенам
|
|
в) алкинам
|
г) алкадиенам
|
|
9.
Тип гибридизации в циклоалканах:
|
|
|
а) Sp3
|
б) Sp2
|
|
в) Sp
|
г) промежуточная между Sp3 и Sp2
|
|
10.
Определите молекулярную формулу циклоалкана, если
плотность паров его по азоту равна 2,5.
|
|
|
а) C3H4
|
б) C5H12
|
|
в) C3H6
|
г) С5H10
|
Ответы:
|
1
|
б
|
|
2
|
б
|
|
3
|
в
|
|
4
|
а
|
|
5
|
г
|
|
6
|
в
|
|
7
|
а
|
|
8
|
б
|
|
9
|
а
|
|
10
|
г
|
















Комментариев нет:
Отправить комментарий