Раздел 6. Важнейшие классы неорганических веществ, их
свойства и способы получения
6.1.
Оксиды и основания, их свойства и способы
Оксидами называют сложные вещества, состоящие из
двух элементов, одним из которых является кислород, находящийся в степени
окисления -2. Примерами оксидов являются Al2O3 - оксид алюминия, SiO2 - оксид кремния, NO - оксид азота(II).
Согласно международной номенклатуре
рассматриваемые соединения называют оксидами
с указанием степени окисления элемента, если этот элемент образует несколько
оксидов. При написании названия степень окисления обозначается римскими
цифрами в скобках, например, FeO – оксид железа (II), Fe2O3 – оксид железа (III), SO2 – оксид серы (IV), SO3 – оксид серы (VI). Очень часто в
литературе встречаются и тривиальные названия оксидов – сурик (Pb3O4),
веселящий газ (N2O), железная окалина (Fe3O4)
и многие др.
Оксиды подразделяются на солеобразующие и
несолеобразующие. Солеобразующие оксиды принято делить на основные, амфотерные и
кислотные.
От оксидов следует отличать пероксиды, например H2O2,
Na2O2 и надперокиды КО2, СsО2. В
этих соединениях степень окисления кислорода по абсолютной величине меньше двух
и может быть дробной.
Основные оксиды образуются только
металлами, им в качестве гидратов соответствуют основания. Например, CaO, FeO,
CuO являются основными оксидами, поскольку им соответствуют основания Ca(OH)2,
Fe(OH)2, Cu(OH)2.
Получение основных оксидов
Основные оксиды получаются:
·
окислением
металлов кислородом:
4 Li + O2 → 2 Li2O,
2 Mg + O2 → 2 MgO;
при окислении щелочных металлов кислородом
только литий образует Li2O. Натрий дает пероксид (Na2O2),
остальные - надпероксиды (КО2 ,
RbO2 , CsO2).
·
разложением
при нагревании кислородных соединений: гидроксидов, нитратов, карбонатов:
2
Fe(OH)3 → Fe2O3 + 3 H2O,
2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2,
CaCO3 → CaO + CO2 (кроме карбонатов щелочных металлов).
·
обжигом
сульфидов:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2.
Химические свойства основных оксидов
Оксиды щелочных и щелочноземельных металлов непосредственно
реагируют с водой:
Na2 O + H2 O → 2 NaOH,
BaO + H2O → Ba(OH)2.
Основные оксиды взаимодействуют с кислотами, образуя соль и воду,
например:
FeO + 2 HCl → FeCl2 + H2O;
Основные оксиды реагируют также с кислотными оксидами:
BaO + CO2 → BaCO3;
Основные оксиды могут также вступать в
окислительно–восстановительные реакции:
Fe2O3 + 3 C → 2 Fe + 3 CO,
CuO + H2 → Cu + H2O.
Кислотные оксиды образуются неметаллами
(SO2, SO3, CO2, P4O10 и т.д.) или переходными металлами,
находящимися в высоких степенях окисления (например, CrO3, Mn2O7).
Кислотные оксиды получают теми же
способами, что и основные оксиды. Например:
C + O2 → CO2,
4 FeS2 + 11O2 → 2 Fe2O3 + 8 SO2,
Zn2(OH)2CO3 → 2 ZnO + CO2 + H2O,
а также
разложением кислот:
H2SiO3 → SiO2 + H2O.
Химические
свойства кислотных оксидов
1. Некоторые кислотные оксиды образуют кислоты при взаимодействии
с водой:
SO3 + H2O → H2SO4,
N2O5 + H2O → 2 HNO3.
Некоторые кислотные оксиды являются ангидридами кислот. Например, SO3 – ангидрид серной кислоты, SO2 – ангидрид сернистой кислоты, CO2 – ангидрид угольной кислоты, P4O10 является ангидридом трех кислот
(метафосфорной НРО3, ортофосфорной Н3РО4,
пирофосфорной Н4Р2О7).
2. Кислотные оксиды взаимодействуют с основными, образуя соли:
SO3 + СаO → CaSO4.
3. Кислотные оксиды взаимодействуют с основаниями, образуя соль и
воду:
CO2 + 2 NaOH → Na2CO3 + H2O.
4. Как и другие типы оксидов, кислотные оксиды могут вступать в
окислительно–восстановительные реакции:
CO2 + 2 Mg → C + 2 MgO,
SO2 + 2 H2S → 3 S + 2H2O.
Амфотерные оксиды обладают двойственными
свойствами, т.е. в зависимости от условий проявляют основные или кислотные
свойства. К ним относятся: ZnO, Al2O3, BeO, Cr2O3 и т. д. Амфотерные оксиды с водой не
взаимодействуют, но реагируют и с кислотами, и с основаниями. Например:
ZnO + H2SO4 → ZnSO4 + H2,
ZnO+ 2 NaOH + H2O → Na2[Zn(OH)4].
Амфотерные оксиды могут взаимодействовать
как с основными, так и с кислотными оксидами:
BeO +
Na2O → Na2BeO2
ZnO +
SO3 → ZnSO4
Амфотерные оксиды при сплавлении со
щелочами или карбонатами щелочных металлов образуют соли:
ZnO + 2
NaOH → Na2ZnO2 + H2O,
Al2O3 + 2 NaOH → 2 NaAlO2 + H2O.
Al2O3 + Na2CO3 → 2 NaAlO2 + CO2
Физические свойства оксидов очень
разнообразны. Все основные и амфотерные оксиды, а также некоторые кислотные
оксиды (SiO2, Р4О10 и др.) являются твердыми веществами.
Многие кислотные оксиды при обычной температуре являются газами (SO2,
CO2) или жидкостями (Cl2O7, Mn2O7).
Свойства несолеобразующих
оксидов (СO, NO, N2O
и др.) будут описаны в следующих разделах, которые посвящены химии
соответствующих элементов.
Следует упомянуть о смешанных оксидах (Pb2O3,
Pb3O4 и
др.), в которых один и тот же элемент (Pb) находится в различных степенях
окисления. Эти соединения можно также отнести к солям: Pb+2Pb+4O3,
Pb2+2Pb+4O2.
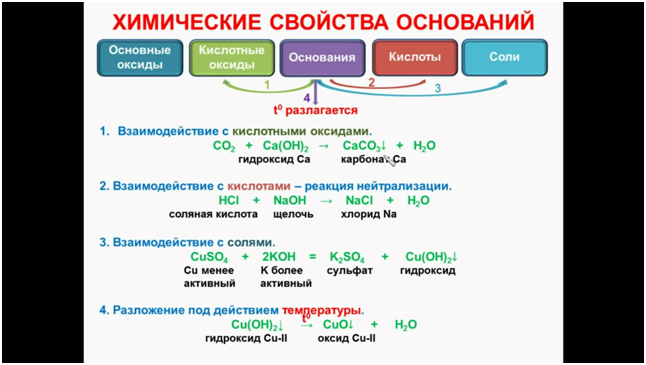
Основаниями
с точки зрения теории электролитической диссоциации являются соединения, при
диссоциации которых в качестве анионов образуются гидроксо-группы ОН–.
Свойствами оснований могут обладать не только гидроксиды металлов, но и
некоторые другие вещества, например, NH3, молекула которого может
присоединить протон:
NH3 + H+ → NH4+
По международной номенклатуре основания принято
называть гидроксидами
элементов: NaOH –
гидроксид натрия, CsOH – гидроксид цезия.
Если элемент может образовывать несколько
оснований, то в названиях в скобках римской цифрой указывается его степень
окисления. Например, Fe(OH)2 –
гидроксид железа (II), Fe(OH)3 –
гидроксид железа (III).
Большинство оснований мало растворимы в
воде. Растворимые в воде основания называются щелочами . Щелочами являются, например,
NaOH, KOH, Ba(OH)2.
Общим способом получения оснований является
реакция обмена между солью и щелочью:
Cu(NO3)2 + 2 KOH → Cu(OH)2 ↓ + 2KNO3 ,
Na2CO3 + Ba(OH)2 → BaCO3 ↓ + 2 NaOH.
Щелочи образуются при взаимодействии
щелочных и щелочноземельных металлов, а также их оксидов с водой:
2 Na +
2 H2O → 2 NaOH + H2 ↓,
BaO + H2O → Ba(OH)2.
В промышленности щелочи обычно получают
электролизом водных растворов хлоридов:
2 KCl +
2 H2O → 2 KOH + H2↓ + Cl2↓.
Растворы щелочей изменяют окраску
индикаторов: бесцветный фенолфталеин переходит в малиновый цвет, метилоранж – в
желтый, лакмус – в синий.
Большинство малорастворимых в воде
оснований при нагревании легко разлагаются:
Cu(OH)2 → CuO + H2O.
Щелочи термически устойчивы и плавятся без
разложения. Исключение составляет гидроксид лития, который также разлагается
при нагревании:
2 LiOH → Li2O + H2O.
Как щелочи, так и нерастворимые основания
могут реагировать с кислотами (реакция нейтрализации):
NaOH +
2 HCl → NaCl + H2O,
2
Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Взаимодействие оснований с кислотными и
амфотерными оксидами рассмотрено в разделе 8.1.
Амфотерные гидроксиды взаимодействуют как
с кислотами, так и с основаниями. Например:
Al(OH)3 + 3 HCl → AlCl3 + H2O
Al(OH)3 + 3 NaOH → Na3[Al(OH)6]
В водных растворах, содержащих щелочь,
наряду с [Al(OH)6]3–, существуют и другие ионы, в
частности, [Al(OH)5]2–, [Al(OH)4]–,
[Al О(OH)4]3– и
др. В гидрооксокомплексах алюминия содержатся также молекулы Н2О,
которые в формулах обычно не указывают.
К амфотерным гидроксидам относятся Zn(OH)2,
Al(OH)3, Cr(OH)3, Be(OH)2, Pb(OH)2 и др.
В заключение следует отметить способность
щелочей взаимодействовать с некоторыми неметаллами и оксидами:
6 KOH +
3 S → K2SO3 + 2 K2S + 3 H2O,
6 NaOH
+ 3 Cl2 → 5 NaCl + NaClO3 + 3 H2O,
2 KOH +
NO2 → KNO2 + KNO3 + H2O.
УПРАЖНЕНИЯ
1. Из приведённого перечня
выберите оксиды, назовите их, определите тип.
1)Na2O2 2) Li2O 3) Al 2O3 4) FeO 5) P2O5 6) CO2 7) OF2 8) MgO
1)Na2O2 2) Li2O 3) Al 2O3 4) FeO 5) P2O5 6) CO2 7) OF2 8) MgO
Решение:
2)Оксид лития (основный)
3)Оксид алюминия (амфотерный)
4)Оксид железа (II) (основный)
5)Оксид фосфора (V) (кислотный)
6)Оксид углерода (IV) (кислотный)
8) Оксид магния (основный)
3)Оксид алюминия (амфотерный)
4)Оксид железа (II) (основный)
5)Оксид фосфора (V) (кислотный)
6)Оксид углерода (IV) (кислотный)
8) Оксид магния (основный)
__________________________________________________________________
2.
С
какими из перечисленных веществ может реагировать а) Li2O б)CO2 в)Al2O3
1)Na2O 2)SO3 3)H2O 4)NaOH 5)H2SO4 6)Na2SO4 7)O2 8) AlCl3
1)Na2O 2)SO3 3)H2O 4)NaOH 5)H2SO4 6)Na2SO4 7)O2 8) AlCl3
Решение:
Li2O реагирует с веществами
2,3,5
CO2 реагирует с веществами 1,3,4
Al2O3 реагирует с веществами 4,5
CO2 реагирует с веществами 1,3,4
Al2O3 реагирует с веществами 4,5
__________________________________________________________________
3.
Из приведённого перечня выберите
основания, назовите их, определите тип.
1) NaOH 2) Li2O 3) Ba(OH)2 4) CuSO4 5) P2O5 6) Al(OH)3 7) HCl 8) C2H5OH
1) NaOH 2) Li2O 3) Ba(OH)2 4) CuSO4 5) P2O5 6) Al(OH)3 7) HCl 8) C2H5OH
Решение:
1)
Гидроксид натрия – однокислотное растворимое основание
3) Гидроксид бария – двухкислотное растворимое основание
6) Гидроксид алюминия – трёхкислотное нерастворимое основание
3) Гидроксид бария – двухкислотное растворимое основание
6) Гидроксид алюминия – трёхкислотное нерастворимое основание
__________________________________________________________________
4.
С какими из перечисленных веществ может реагировать а) NaOH б) Cu(OH)2
1)Na2O 2)SO3 3)H2O 4)NaOH 5)H2SO4 6)Na2SO4 7) HCl 8) AlCl3
1)Na2O 2)SO3 3)H2O 4)NaOH 5)H2SO4 6)Na2SO4 7) HCl 8) AlCl3
Решение:
NaOH реагирует с веществами 2,5,7,8
Cu(OH)2 реагирует с веществами 5,7
Cu(OH)2 реагирует с веществами 5,7
__________________________________________________________________
5. На 47 г оксида
калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося
нитрата калия.
Решение:
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(K2O) =
2Ar(K) + 1Ar(O) = 2•39 + 1•16 = 94,
Mr(HNO3) =
1Ar(H) + 1Ar(N) + 3Ar(O)
= 1•1 + 1•14 + 3•16 = 63,
Mr(KNO3) =
1Ar(K) + 1Ar(N) + 3Ar(O)
= 1•39 + 1•14 + 3•16 = 101.
Для
удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших
в реакцию, дано в избытке, какое – в недостатке.
47/94
= х1/126, х1 = 63 г.
Следовательно,
азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету
необходимо 63 г, поэтому расчет ведем по HNO3:
40/126
= х/202, х = 64 г.
Ответ. m(КNO3) = 64 г.
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Закончите уравнения реакций в молекулярном и ионном
виде:
2. Напишите
уравнения двух реакций получения: а) гидроксида цезия, б) гидроксида железа (III).
3. С помощью каких
реакций можно получить оксид никеля (II) NiO из
сульфата никеля (II) NiSO4 ?
4. Напишите
уравнения реакций всех способов получения оксида хрома (III), оксида углерода (IV),
оксида кальция.
5. С какими из
следующих веществ будет реагировать оксид углерода (IV):
Напишите уравнения соответствующих реакций.
6. С какими из
следующих веществ будет реагировать гидроксид калия:
Напишите уравнения соответствующих реакций в
молекулярном и ионном виде.
7. С какими из
следующих веществ будет реагировать оксид цинка:
Напишите уравнения соответствующих реакций
в молекулярном и ионном виде.
8. Можно ли
приготовить раствор, содержащий одновременно следующие вещества:
9. Оксид натрия
массой 12,4 г растворили в воде. Какой
объем оксида углерода (IV), измеренный
при нормальных условиях, потребуется для нейтрализации полученного гидроксида
натрия, если при этом образуется кислая соль?
10.
Сколько
граммов гидроксида железа (III) надо
разложить, чтобы получить 0,95 г оксида железа (III)?
|
1.
В каком ряду указаны формулы только кислотных
оксидов:
|
|
|
а) CO2, K2O, SO3
|
б) P2O5, Mn2O7, SiO2
|
|
в) CO, Cl2O7, CuO
|
г) CrO3,
P2O3, BaO
|
|
2.
Отметьте символ элемента, образующего как
кислотный, так и основной оксиды:
|
|
|
а) K
|
б) S
|
|
в) Cu
|
г) Mn
|
|
3.
В каком ряду указаны формулы оксидов, все из
которых реагируют с разбавленным раствором
NaOH с образованием солей:
|
|
|
а) P2O5,
Al2O3,
FeO
|
б) CO2,
SO2, Al2O3
|
|
в) Mn2O7, CaO,
SiO2
|
г) K2O,
SO3, ZnO
|
|
4.
Все оксиды какого ряда реагируют с серной
кислотой:
|
|
|
а) оксид алюминия, оксид железа (II), оксид углерода (IV)
|
б) оксид бария, оксид азота (V), оксид
кремния (IV)
|
|
в) оксид алюминия, оксид железа(III), оксид
меди (II)
|
г) оксид цинка, оксид калия, оксид
хлора (VII)
|
|
5.
В каком ряду указаны формулы основного, амфотерного
и кислотного оксидов:
|
|
|
а) CaO, CO2, Al2O3
|
б) CaO, K2O, Al2O3
|
|
в) Fe2O3, SO3, P2O5
|
г) CO2, SO3, ZnO
|
|
6.
Оксиды фосфора (V) и алюминия являются соответственно:
|
|
|
а) кислотным и основным
|
б) основным и кислотным
|
|
в) кислотным и амфотерным
|
г) основным и амфотерным
|
|
7.
Оксид фосфора (V) не реагирует с:
|
|
|
а) водой
|
б) щелочами
|
|
в) основными оксидами
|
г) кислотами
|
|
8.
В какой группе указаны формулы только щелочей:
|
|
|
а)NaOH, Ca(OH)2, Mg(OH)2
|
б) KOH, NH4OH, Cu(OH)2
|
|
в) NaOH,
KOH, Ba(OH)2
|
г) LiOH, KOH, Fe(OH)2
|
|
9.
С какими веществами из перечисленных не реагируют щелочи:
|
|
|
а) растворимыми солями меди
|
б) слабыми кислотами
|
|
в) основными оксидами
|
г) амфотерными гидроксидами
|
|
10.
Щелочь
не может
образоваться при взаимодействии:
|
|
|
а) калия и воды
|
б) карбоната натрия и гидроксида бария
(водные растворы)
|
|
в) хлорида алюминия и гидроксида
аммония (водные растворы)
|
г) оксида натрия и воды
|
Ответы:
|
1
|
б
|
|
2
|
г
|
|
3
|
б
|
|
4
|
в
|
|
5
|
а
|
|
6
|
в
|
|
7
|
г
|
|
8
|
в
|
|
9
|
в
|
|
10
|
в
|











Комментариев нет:
Отправить комментарий