10.3.
Альдегиды
КАРБОНИЛЬНЫЕ
СОЕДИНЕНИЯ -
органические
вещества, содержащие карбонильную группу
АЛЬДЕГИДЫ
|
|||
ОБЩАЯ ФОРМУЛА:
RCOH или СnH2nO
|
|||
Предельные
CnH2n+1-CН=О
|
Непредельные
CH2=CH-CН=О
акролеин
|
Ароматические
С6H5-CН=О
бензальдегид
|
|
Суффикс - АЛЬ
|
|||
Изомерия альдегидов:
1.
изомерия углеродного скелета, начиная с С4
2.
межклассовая изомерия с кетонами, начиная с С3
3.
циклическими оксидами (с С2)
4.
непредельными спиртами и простыми эфирами (с С3)
|
|||
КЕТОНЫ
|
|||
ОБЩАЯ
ФОРМУЛА: RCOR1 или СnH2nO
|
|||
Суффикс - ОН
|
|||
Изомерия кетонов:
1.
углеродного скелета (c C5)
2.
положения карбонильной группы (c C5)
3.
межклассовая изомерия (аналогично альдегидам).
|
|||
Номенклатура альдегидов и кетонов
Систематические
названия альдегидов строят по названию соответствующего
углеводорода с добавлением суффикса -аль. Нумерацию цепи начинают с
карбонильного атома углерода.
Тривиальные
названия производят от тривиальных названий тех кислот, в которые альдегиды
превращаются при окислении.
Формула
|
Название
|
|
систематическое
|
тривиальное
|
|
H2C=O
|
метаналь
|
муравьиный
альдегид (формальдегид)
|
CH3CH=O
|
этаналь
|
уксусный
альдегид (ацетальдегид)
|
CH3CH2CH=O
|
пропаналь
|
пропиновый
альдегид
|
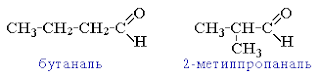
CH3CH2CH2CH=O
|
бутаналь
|
масляный
альдегид
|
(CH3)2CHCH=O
|
2-метил-пропаналь
|
изомасляный
альдегид
|
CH3CH2CH2CH2CH=O
|
пентаналь
|
валериановый
альдегид
|
CH3CH=CHCH=O
|
бутен-2-аль
|
кротоновый
альдегид
|
Систематические
названия кетонов производят от названий радикалов (в порядке
увеличения) с добавлением слова кетон.
Например:
CH3–CO–CH3 -
диметилкетон (ацетон);
CH3CH2CH2–CO–CH3 - метилпропилкетон.
CH3CH2CH2–CO–CH3 - метилпропилкетон.
В более
общем случае название кетона строится по названию соответствующего углеводорода
и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к
карбонильной группе.
Примеры:
CH3–CO–CH3 - пропанон (ацетон);
CH3CH2CH2–CO–CH3 - пентанон-2;
CH3CH2CH2–CO–CH3 - пентанон-2;
Физические свойства альдегидов
Метаналь
(формальдегид) – газ, альдегиды С2-C5 и кетоны С3-С4 –
жидкости, высшие – твердые вещества. Низшие гомологи растворимы в воде,
благодаря образованию водородных связей между атомами водорода молекул воды и
карбонильными атомами кислорода. С увеличением углеводородного радикала
растворимость в воде падает.
Альдегиды
обладают удушливым запахом, который при многократном разведении становится
приятным, напоминая запах плодов. Альдегиды кипят при более низкой температуре,
чем спирты с тем же числом углеродных атомов. Это cвязано с отсутствием в
альдегидах водородных связей. В то же время температура кипения альдегидов
выше, чем у соответствующих по молекулярной массе углеводородов, что связано с
высокой полярностью альдегидов.
Физические свойства некоторых альдегидов:
Формальдегид – газ, с резким запахом, раздражает
слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ
ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
Ацетальдегид – жидкость , с запахом зелёной
листвы. ОЧЕНЬ ТОКСИЧЕН! Подавляет дыхательные процессы в клетках.
Акролеин СН2 = CHCH=O акриловый
альдегид, пропеналь (в
производстве полимеров) – образуется при пригорании жиров, жидкость с
неприятным запахом, раздражает слизистые ткани.
Бензальдегид C6H5CH=O (производство
красителей) – жидкость с запахом горького миндаля, содержится в миндале,
листьях черёмухи, косточках персиков, абрикосов.
Строение карбонильной группы
Свойства альдегидов и кетонов определяются строением карбонильной группы
>C=O.
Альдегиды
характеризуются высокой реакционной способностью. Большая часть их реакций
обусловлена наличием карбонильной группы.
Атом
углерода в карбонильной группе находится в состоянии sp2 -гибридизации
и образует три s- связи (одна из них – связь С–О), которые расположены в одной
плоскости под углом 120° друг к другу.
Схема строения карбонильной группы
Связь С=О
сильно полярна. Электроны кратной связи С=О, в особенности более подвижные
π-электроны, смещены к электроотрицательному атому кислорода, что приводит к
появлению на нем частичного отрицательного заряда. Карбонильный углерод
приобретает частичный положительный заряд
Поэтому
углерод подвергается атаке нуклеофильными реагентами, а кислород
электрофильными, в том числе Н+. Важнейшими реакциями альдегидов
являются реакции нуклеофильного присоединения по двойной связи карбонильной
группы.
Получение
альдегидов
I. В промышленности
Этот способ
более перспективен, чем гидратация алкинов, при которой используются токсичные
ртутные катализаторы.
В
промышлености альдегиды и кетоны получают дегидрированием спиртов,
пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr
или Zn).
Этот способ
позволяет получать карбонильные соединения, в особенности альдегиды, без
побочных продуктов окисления.
II. В лаборатории
1. Гидратация алкинов (раньше использовали в
промышленности – способ дорогой) - присоединение:
Присоединение воды к ацетилену в
присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны
получают при гидратации других гомологов ряда алкинов:
2. Окисление спиртов:
Первичные
спирты при окислении образуют альдегиды, которые затем легко окисляются до
карбоновых кислот.
Чтобы предотвратить превращение альдегида в кислоту, его отгоняют в
ходе реакции (tкип альдегида,
не образующего межмолекулярные водородные связи, нижеtкип спирта и кислоты).
При окислении вторичных спиртов образуются кетоны.
Химические свойства альдегидов
Для
карбонильных соединений характерны реакции различных типов:
· присоединение
по карбонильной группе;
· полимеризация;
· конденсация;
· восстановление
и окисление.
Большинство
реакций альдегидов и кетонов протекает по механизму нуклеофильного
присоединения (AN) по связи С=О.
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Это
объясняется, главным образом, двумя факторами:
Ø углеводородные радикалы у группы С=О
увеличивают пространственные препятствия присоединению к карбонильному атому
углерода новых атомов или атомных групп;
Ø углеводородные радикалы за счет +I-эффекта
уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет
присоединение нуклеофильного реагента.
I. Реакции присоединения
1. Присоединение водорода (восстановление):
R-CH=O + H2 t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной):
Эта реакция
используется для удлинения углеродной цепи, а также для получения
α-гидроксикислот R-CH(COOH)OH по схеме:
R-CH(CN)OH + H2O -> R-CH(COOH)OH + NH3
CH3-CH=O + H-CN → CH3-CH(CN)-OH
CH3-CH(CN)-OH циангидрин –яд! в ядрах косточек
вишен, слив
3. Со спиртами – получают полуацетали и ацетали:
Полуацетали - соединения, в которых атом
углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
Ацетали - соединения, в которых атом
углерода связан с двумя алкоксильными
(-OR)
группами.
4. Присоединение воды:
R-X(р-р в диэтиловом эфире) + Mg стружка → R-Mg-X (реактив Гриньяра) + Q
Здесь R –
алкильный или арильный радикал; Х – это галоген.
HCH=O + CH3-Mg-Cl → CH3-CH2-O-Mg-Cl (присоединение)
CH3-CH2-O-Mg-Cl + H2O → CH3-CH2-OH + Mg(OH)Cl
(гидролиз)
II. Реакции окисления
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
2. Окисление гидроксидом меди(II):
3. Альдегиды могут
быть окислены до кислот бромной водой
III. Реакции замещения
С галогенами:
CH3-CH=O + Cl2 → ClCH2-CH=O + HCl
здесь , ClCH2-CH=O - хлоруксусный альдегид
n CH2=O t,kat → ( -CH2-O-)n полиформальдегид
n H-CH=O + (n+1) C6H5-OH t,kat→ nH2O + [-C6H3(OH)-CH2-C6H3(OH)-]n
фенолформальдегидная
смола
Применение
Метаналь (муравьиный альдегид) CH2=O
·
получение
фенолформальдегидных смол;
·
получение мочевино-формальдегидных
(карбамидных) смол;
·
полиоксиметиленовые
полимеры;
·
синтез
лекарственных средств (уротропин);
·
дезинфицирующее
средство;
·
консервант
биологических препаратов (благодаря способности свертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О
·
производство
уксусной кислоты;
·
органический
синтез.
Кетоны – органические вещества, молекулы
которых содержат карбонильную группу, соединенную с двумя углеводородными
радикалами.
Общие
формулы: R2C=O, R–CO–R' или
R, R' = алкил, арил
|
Ацетон (пропанон-2, диметилкетон) СН3СОСН3,
летучая бесцветная жидкость с характерным запахом. Смешивается с водой и
органическими растворителями, например эфиром, метанолом, этанолом, сложными
эфирами. Незначительное количество ацетона, образующееся в организме
человека в результате метаболических реакций, выводится вместе с мочой. У
больных диабетом следы ацетона можно обнаружить во выдыхаемом воздухе.
Применение
Ацетон
является ценным растворителем, использующимся в лакокрасочной промышленности, в
производстве искусственного шелка, кинопленки, бездымного пороха. Он служит
также исходным сырьем при производстве метакриловой кислоты, метилметакрилата
(производство небьющегося органического стекла), метилизобутилкетона и др.
УПРАЖНЕНИЯ
1. Уксусная кислота содержит примеси уксусного
альдегида и этанола. Образец кислоты массой 20 г обработали избытком аммиачного
раствора оксида серебра и получили 13,5 г осадка. На нейтрализацию такого же
образца кислоты израсходовали 25,65 мл раствора с массовой долей гидроксида
натрия 30% и плотностью 1,3 г/см3. Вычислить массовые доли примесей
в кислоте.
Решение:
Составить уравнения реакций:
Найди массу альдегида по уравнению реакции
(1):
m(СН3С(О)Н) = 44•13,5/216 = 2,75 г.
Вычислить массу NaOH, вступившего в реакцию:
m(NaOH) = 25,65•1,3•0,3 = 10 г.
Определить массу уксусной кислоты, расходуемой
в реакции (2):
m(СН3СООН) = 10•60/40 = 15 г.
Найти массу этанола в исходной смеси:
m(С2Н5ОН) = 20 – 15 – 2,75 = 2,25 г.
Рассчитать массовые доли спирта и альдегида в
кислоте:
(С2Н5ОН) = 2,25/20 =
0,1125, или 11,25%;
(СН3С(О)Н) = 2,75/20 = 0,1375,
или 13,75%.
Ответ. (С2Н5ОН)
= 11,25%,
(СН3С(О)Н) = 13,75%.
________________________________________________________________
2. Вычислите, сколько граммов уксусного
альдегида получится, при окислении 100 г 40%-ного водного раствора
этилового спирта, если выход реакции составляет 75%?
Решение:
1. Сколько
в реакцию вступило спирта?
m(C2H5OH)
= m раствора = 100 г 0,4 = 40 г
n (C2H5OH)
= = = 0,87 моль.
2. Согласно
уравнению реакции
CH3–CH2–OH
+ CuO → CH3–CHO + Cu + H2O при окислении одного моль
спирта получается 1 моль альдегида, значит, при окислении 0,87 моль
спирта получается 0,87 моль альдегида.
3. Учтем
выход продукта реакции:
m теор. = 0,87 моль = 38,28 г
;
m практ = m
теор . = 38,28 г 0,75 = 28,71 г или 29 г.
________________________________________________________________
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Напишите
структуры и назовите по номенклатуре ИЮПАК следующие соединения: ацетальдегид,
формальдегид, ацетон, метилэтилкетон.
2. Напишите
реакцию ацетона с бромом (получение монобромацетона). В какой среде (кислой или
щелочной) следует проводить реакцию?
3. Какой
спирт образуется при восстановлении водородом в присутствии медного или
никелевого катализаторов 2,2,3-триметилгексаналя?
4. Как
разделить пропанол-1 и пропионовый альдегид, не разрушив при этом ни то, ни
другое?
5. Как из
пропана получить ацетон? Напишите схемы реакций и назовите промежуточные
соединения.
6. Укажите,
при помощи каких реакций можно различить соединения: а) ацетон и уксусный
альдегид; б) гексен-4-он-2 и гексанон-3. Напишите схемы реакций.
7. Назовите
следующие соединения по международной номенклатуре:
8. Напишите
уравнения реакций следующих превращений:
9. Какого
состава соль образуется и какова ее концентрация в растворе, полученном при
растворении в 76,8 мл 28 %-го раствора КОН (p = 1,3 г/мл) продуктов сгорания 9,7 г пропионового
альдегида.
10. Сколько
граммов ацетальдегида образовалось при окислении этилового спирта (массовая
доля выхода ацетальдегида – 75 % от теоретического), если известно, что при
взаимодействии такого же количества спирта с металлическим натрием выделилось
5,6 л водорода (н.у.).
ВИДЕО ОПЫТ
1.
Состав альдегидов может выражаться формулой:
|
|
а) CnH2n+1O
|
б) CnH2n+2O
|
в) CnH2nO
|
г) CnH2nO2
|
2.
Какой вид изомерии возможен для предельных
альдегидов:
|
|
а) положения альдегидной группы
|
б) углеродного скелета
|
в) геометрическая цис-транс изомерия
|
г) межклассовая изомерия спиртам
|
3.
Сколько изомерных альдегидов имеет общую формулу С4Н8О:
|
|
а) 3
|
б) 2
|
в) изомеров нет
|
г) 4
|
4.
При
взаимодействии предельных альдегидов с водородом образуются:
|
|
а) карбоновые кислоты
|
б) простые эфиры
|
в) вторичные спирты
|
г) первичные спирты
|
5.
При восстановлении пропаналя образуется:
|
|
а) пропановая кислота
|
б) пропанол-2
|
в) пропанол-1
|
г) изопропиловый спирт
|
6.
Какой спирт образуется при восстановлении
3-метилбутаналя:
|
|
а) третичный бутиловый
|
б) 2-метилбутанол-1
|
в) 3-метилбутанол-1
|
г) 2-метилбутанол-4
|
7.
Какое вещество является изомером 2-метилпропаналя:
|
|
а) 1-бутанол
|
б) бутаналь
|
в) валериановый альдегид
|
г) пентаналь
|
8.
Ацетальдегид получается при окислении:
|
|
а) муравьиной кислоты
|
б) метанола
|
в) уксусной кислоты
|
г) этанол
|
9.
Ацетальдегид окисляют с целью получения:
|
|
а) этанола
|
б) диэтилового эфира
|
в) уксусной кислоты
|
г) формальдегида
|
10.
Формальдегид получается при окислении:
|
|
а) муравьиной кислоты
|
б) метанола
|
в) этанола
|
г) уксусной кислоты
|
Ответы:
1
|
в
|
2
|
б
|
3
|
б
|
4
|
г
|
5
|
в
|
6
|
в
|
7
|
б
|
8
|
г
|
9
|
в
|
10
|
б
|





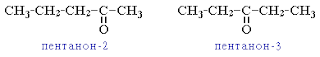










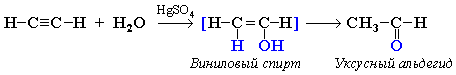
























1 комментарий:
Дайте ответы на 10 заданий
Отправить комментарий