10.2.
Фенолы
Термин фенолы происходит
от старинного названия бензола «Фен», введенного Лораном в 1837 г.,
и обозначает ароматическое вещество, содержащее гидроксил, связанный
непосредственно с ароматическим кольцом.
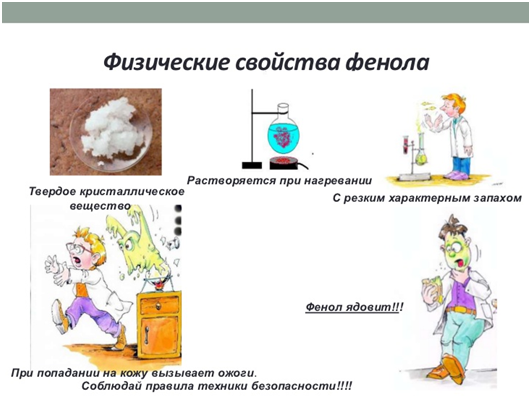
Сам фенол – бесцветное легкоплавкое кристаллическое вещество, с
характерным запахом, быстро розовеющее на воздухе вследствие окисления. Немного растворяется в
воде (8 % при 15 °С), вода растворяется в феноле с образованием
жидких растворов.
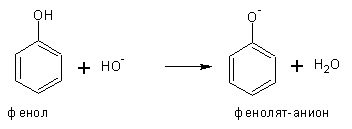
Фенол растворяется в щелочах с
образованием фенолятов. Однако уже СО2 способна выделять
фенол из растворов фенолятов. Фенол – слабая кислота, гораздо слабее уксусной
кислоты, но на несколько порядков кислее воды, не говоря уже об алифатических
спиртах. Кислотные свойства фенолов выражены гораздо ярче, чем у спиртов, благодаря
описанной ниже делокализации отрицательного заряда от кислорода в кольцо, что
стабилизирует анион фенолята, тем самым облегчая отщепление протона и
проявление кислотных свойств:
Алифатические спирты на такую
делокализацию неспособны. Более того, в отличие от воды они являются более
слабыми кислотами, поскольку алкоголят-анион у них дестабилизирован
положительным индуктивным (электронодонорным) эффектом алкильных групп:
Номенклатура
Если ароматическое кольцо содержит одну
гидроксильную группу, то это одноатомные фенолы:
При наличии двух и более гидроксильных
групп фенолы называют, соответственно, двух-, трехатомными и т.д.
При наименовании фенолов широко
применяется тривиальная номенклатура.
Химические свойства
фенолов
Реакции гидроксила фенолов
1. Образование фенолятов
2. Образование простых эфиров
фенолов взаимодействием фенолятов с галоидными алкилами или диметилсульфатом
(СН3-О-SO2-O-CH3):
3. Образование сложных эфиров
фенолов
Не может быть проведено взаимодействием с
кислотами, проводят реакцией фенолятов (в щелочной среде) с галогенангидридами
или ангидридами кислот:
4. Реакция фенола с галоидами
фосфора вместо замещения гидроксила на галоген приводит к образованию эфиров
фосфористой (если реагирует с PCl3) или фосфорной (если реагирует с
PCl5) кислот:
(трифенилфосфит)
5. При перегонке с цинковой
пылью фенолы превращаются в углеводороды (бензол).
Реакции ароматического
ядра фенолов
1. Галоидирование фенолов
Гидроксил- один из сильнейших, а в
щелочной среде- самый сильный орто- пара- ориентант,
поэтому реакции электрофильного замещения для фенолов легко протекают с
элементарными галогенами (включая иод) и при этом образуются тризамещенные
производные (особенно в водной среде).
Бромирование фенола избытком бромной воды
проходит по схеме:
2. Сульфирование
фенолов
3. Нитрование
фенолов
Мононитропроизводные фенолов получают
нитрованием разбавленной азотной кислотой на холоду.
2,4-динитрофенол проще получить гидролизом
2,4-динитрохлорбензола.
Тринитрофенол (пикриновую кислоту)
получают в промышленном масштабе, нитруя крепким нитрующим раствором
2,4-фенолдисульфокислоту, получаемую сульфированием фенола (не выделяя ее из
реакционной массы). Наличие сульфогрупп, удаляемых по мере протекания
нитрования, защищает фенол от окисления азотной кислотой:
Если нитровать в присутствии соли ртути
бензол, то образующийся м-динитробензол окисляется до 2,4-динитрофенола,
который нитруется далее.
Свойства нитрофенолов
Нитрофенолы – гораздо более сильные
кислоты, особенно если нитрогруппа находится в орто- или пара-положениях
к гидроксилу (и, тем более, если она не одна). Орто-нитрофенол довольно резко
отличается от своего пара-изомера и от самого фенола тем, что он не ассоциирован
в углеводородных растворах. Фенол, как и все гидроксильные соединения,
ассоциирован за счет образования водородных связей между гидроксилами, а п-нитрофенол
еще и за счет Н-связей между нитрогруппой одной молекулы и гидроксилом другой.
В орто-нитрофеноле водородная связь осуществляется внутри молекулы,
поэтому гидроксил уже не способен к образованию гидроксильных связей на
стороне. Такое строение обуславливает более низкую температуру плавления, большую
растворимость и способность перегоняться с водяным паром (молекулы не связаны
друг с другом), а также окраску.
4. Реакция Кольбе (фенол с СО2 a
салициловая кислота)
При нагревании фенолята натрия в токе СО2 образуется
салицилат натрия (реакция Кольбе). При действии на фенолят четыреххлористого углерода
CCl4 также образуется салицилат натрия, а при действии
хлороформа – салициловый альдегид (реакция Реймера–Тимана):
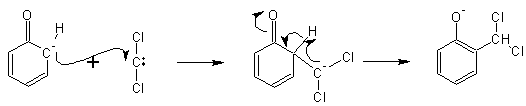
5. Реакция
Реймера–Тимана
(фенол + CHCl3, CCl4)
На предварительном этапе образуется
электронодефицитный дихлоркарбен: CCl2 (секстет
электронов на внешнем уровне):
(HO- +
H–CCl3 a HOH + CCl3- a :CCl2 +
Cl-).
Дихлоркарбен легко присоединяется к
обогащенному электронной плотностью кольцу:
Образующееся дихлорпроизводное легко
гидролизуется до альдегидной группировки (салициловый альдегид).
6. Конденсация фенолов с
формальдегидом. Фенолоформальдегидные смолы
Наибольший интерес представляет собой
конденсация фенола с формальдегидом, бурно протекающая в присутствии серной
кислоты с образованием вначале линейного полимера, называемого «новолак»:
Если взять формальдегид в избытке и
проводить конденсацию в щелочной среде, сначала образуется легкоплавкий и
сравнительно низкомолекулярный полимер – резол. Это т.н.
термореактивный полимер: при нагревании протекает дальнейшая конденсация
свободных оксиметиленовых групп с образованием метиленовых мостов и полимер
приобретает сетчатую структуру. Получаемый резитол нерастворим
в органических растворителях, но сохраняет некоторую пластичность. При
нагревании до 150 °С полимеризация идет дальше и получается неплавкий и
нерастворимый полимер – резит.
Резол (или Бакелит А) –
стекловидная масса, осаждающаяся после проведения конденсации фенола с
формальдегидом в щелочной среде при 80 °С (соотношение 1:1). Смола
растворяется в ацетоне.
При непродолжительном нагревании при
150 °С твердеет окончательно, превращаясь в резит (Бакелит
С), обугливающийся без плавления при 300 °С.
Резитол – промежуточное состояние (Бакелит
В), растворяется плохо, но еще пластичен.
На основе фенолоформальдегидных полимеров
могут быть получены наполненные пластики, обладающие высокой прочностью и
устойчивостью к истиранию. Например, на основе пропитанной полимером бумаги
штампуются отличные зубчатые колеса и шестеренки.
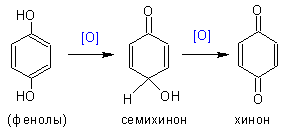
7. Окисление фенолов
Фенол и его гомологи (в особенности –
содержащие электронодонорные группировки) легко отдают гидрид-ион (окисляются)
до хинонов и семихинонов:
Способы получения фенолов
1. Самый старый способ –
щелочное плавление бензолсульфокислоты:
2. Некоторое количество фенола
получают по способу Рашига, гидролизом хлорбензола парами воды над
промотированным Cu2+ силикагелем при 450–500 °С:
3. Окисление изопропилбензола (кумола)
кислородом воздуха:
Имеет ценное практические применение,
поскольку в одну стадию получаются два ценных продукта. Изопропилбензол
получается алкилированием бензола. Реакция окисления имеет радикальный характер
и протекает с промежуточным образованием перекиси и перегруппировкой (сдвигом
бензольного кольца).
4. Введение гидроксила на место
аминогруппы (диазотирование) не применяется для самого фенола, но
таким способом получают другие производные:
УПРАЖНЕНИЯ
1. Для
нейтрализации смеси этилового спирта и фенола потребовалось 25 мл 40%-го
раствора гидроксида калия (плотность 1,4 г/мл). При обработке этой смеси
натрием выделилось 6,72 л газа (н.у.). Определите массовые доли компонентов в
исходной смеси.
Решение:
С
гидроксидом калия реагирует только фенол, а с натрием взаимодействует как
фенол, так и спирт. Используем обозначения: масса фенола в смеси m(С6Н5ОН)
= х; m(KOH) = k; объем водорода,
выделившегося в реакции (б), V(H2)б = у;
масса спирта m(C2H5OH)
= z.
Запишем уравнения реакций:
Запишем уравнения реакций:
С помощью формулы m =  •V определим массу 25 мл 40%-го раствора
КОН:
•V определим массу 25 мл 40%-го раствора
КОН:
m(40%-й КОН)
= 1,4•25 = 35 г.
Масса вещества КОН в
40%-м растворе КОН равна:
m(КОН) =  в-ва (%)•m(р-ра)/100(%) = 40•35/100
= 14 г, т.е. k = 14 г.
в-ва (%)•m(р-ра)/100(%) = 40•35/100
= 14 г, т.е. k = 14 г.
Количество вещества:  (КОН) = m/M = 14/56 = 0,25 моль;
(КОН) = m/M = 14/56 = 0,25 моль;
Масса фенола: m(С6Н5ОН)
=  • М = 0,25•94 = 23,5 г.
• М = 0,25•94 = 23,5 г.
Подставим значение х = 23,5 г в уравнение (б) и найдем
неизвестный объем Н2 у:
23,5/(2•94) = у/22,4,
у =
23,5•22,4/188 = 2,8 л Н2.
Объем водорода,
выделившегося в реакции (в):
V(H2)в = 6,72 – 2,8 = 3,92 л.
Из уравнения (в)
найдем массу спирта:
z/(2•46) =
3,92/22,4,
z =
2•46•3,92/22,4 = 16,1 г.
Масса смеси спирта и
фенола равна: 16,1 + 23,5 = 39,6 г.
Массовая доля спирта в смеси:
Массовая доля спирта в смеси:
Ответ. В
смеси 40,7% спирта и 59,3% фенола.
________________________________________________________________
2.
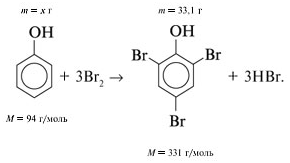
Смесь ароматического углеводорода (гомолога
бензола) и фенола общей массой 14 г обработали бромной водой (реагирует только
фенол). При этом выпало 33,1 г осадка. Определите структурную формулу
ароматического углеводорода, если известно, что он находился в исходной смеси в
количестве 0,05 моль.
Решение:
Уравнение реакции фенола с бромом (в воде):Значит, масса ароматического углеводорода равна: 14 – 9,4 = 4,6 г.
Молярная масса искомого арена: М = m/
Это толуол СН3С6Н5.
Ответ. СН3С6Н5.
________________________________________________________________
3.
________________________________________________________________
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Напишите
схемы реакций фенола с: а) бромной водой, б) раствором HNO3.
2.
Почему
фенол является более сильной кислотой, чем вода, а вода – более сильной
кислотой, чем этанол? Какие электронные эффекты ответственны за повышенную
кислотность фенола (по сравнению с водой и этанолом)?
3.
По
каким причинам фенол бромируется с легкостью бромной водой и дает
2,4,6-трибромфенол, в то время как для бромирования бензола требуется
катализатор и получается только бромбензол?
4.
Какие типы изомерии возможны для
фенолов.
5.
Объясните взаимное влияние атомов в
молекуле фенола. Чем отличаются фенолы от спиртов по свойствам.
6.
Назовите следующие соединения:
7.
Напишите структурные формулы
изомерных фенолов и ароматических спиртов состава С8Н10О.
8.
Напишите уравнения реакций
получения из бензола: а) пирокатехина;
б) гидрохинона.
9.
На нейтрализацию смеси фенола с
этанолом затратили раствор объемом 50 мл с массовой долей гидроксида натрия 18%
и плотностью 1,2 г/мл. Такая же масса смеси прореагировала с металлическим
натрием массой 9,2 г. Определите массовые доли фенола и этанола в смеси.
10.
14 г смеси ароматического углеводорода,
являющегося гомологом бензола, и фенола обработали бромной водой, при этом
выпало 33,1 г осадка. Определить структурную формулу ароматического
углеводорода, если известно, что его в исходной смеси находилось 0,05 моль.
ВИДЕО ОПЫТ
1.
С каким веществом реагируют как фенол, так и
этиловый спирт:
|
|
а) хлороводород
|
б) калий
|
в) водный раствор гидроксида калия
|
г) гидрокарбонат натрия
|
2.
Различить пробирки с безводными растворами фенола
и этанола можно с помощью:
|
|
а) натрия
|
б) гидроксида калия
|
в) бромной воды
|
г) хлороводорода
|
3.
Укажите число сигма-связей в молекуле фенола:
|
|
а) 11
|
б) 12
|
в) 13
|
г) 15
|
4.
В отличие от этанола фенол реагирует с:
|
|
а) калием
|
б) водным раствором КОН
|
в) хлороводородом
|
г) гидросульфатом калия
|
5.
Какой из указанных реагентов применяют для
качественного обнаружения фенолов:
|
|
а) NaCl
|
б) Cu(OH)2
|
в) FeCl3
|
г) CuSO4
|
6.
Найдите число всех возможных изомеров фенолов с
молекулярной формулой С7Н8О:
|
|
а) 6
|
б) 5
|
в) 4
|
г) 3
|
7.
Найдите число атомов, находящихся в одной
плоскости в молекуле фенола:
|
|
а) 10
|
б) 11
|
в) 12
|
г) 13
|
8.
Фенолят натрия образуется при взаимодействии
фенола с:
|
|
а) натрием
|
б) серой
|
в) нитратом натрия
|
г) хлоридом натрия
|
9.
При взаимодействии каких пар веществ можно
получить фенолят калия:
|
|
а) фенол и калий
|
б) фенол и цинк
|
в) ацетат калия и фенол
|
г) фенол и хлорид калия
|
10.
С каким
веществом реагирует как фенол, так и бензол:
|
|
а) бром
|
б) натрий
|
в) водный раствор гидроксида натрия
|
г) калий
|
Ответы:
1
|
б
|
2
|
в
|
3
|
в
|
4
|
б
|
5
|
в
|
6
|
г
|
7
|
в
|
8
|
а
|
9
|
а
|
10
|
а
|

























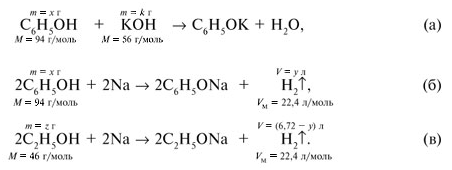





Комментариев нет:
Отправить комментарий