Раздел 4. Классификация химических реакций и
закономерности их протекания
4.1. Окислительно-восстановительные реакции.
Важнейшие окислители и восстановители
Многие химические реакции уравниваются простым подбором коэффициентов. Но
иногда возникают сложности: количество атомов какого-нибудь элемента в левой и
правой частях уравнения никак не удается сделать одинаковым без того, чтобы не
нарушить "равновесия" между атомами других элементов.
Чаще всего такие сложности возникают в уравнениях
окислительно-восстановительных реакций. Для их уравнивания используют несколько
способов, из которых мы пока рассмотрим один – метод электронного баланса.
Напишем уравнение реакции между алюминием и кислородом:
Al + O2 = Al2O3
Пусть вас не вводит в заблуждение простота этого уравнения. Наша задача –
разобраться в методе, который в будущем позволит вам уравнивать гораздо более
сложные реакции.
Итак, в чем заключается метод электронного баланса? Баланс – это равенство.
Поэтому следует сделать одинаковым количество электронов, которые отдает один
элемент и принимает другой элемент в данной реакции.
Первоначально это количество выглядит разным, что видно из разных степеней окисления
алюминия и кислорода:
0
|
0
|
+3 –2
|
||
Al
|
+
|
O2
|
=
|
Al2O3
|
Алюминий отдает электроны (приобретает положительную степень окисления), а
кислород – принимает электроны (приобретает отрицательную степень окисления).
Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона.
Молекула кислорода, чтобы превратиться в кислородные атомы со степенью
окисления -2, должна принять 4 электрона:
Чтобы количество отданных и принятых электронов выровнялось, первое
уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить
числа отданных и принятых электронов против верхней и нижней строчки так, как
показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный
нами коэффициент 4, а перед окислителем (O2) – найденный нами
коэффициент 3, то количество отданных и принятых электронов выравнивается и
становится равным 12. Электронный баланс достигнут. Видно, что перед продуктом
реакции Al2O3 необходим коэффициент 2. Теперь
уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных
случаях, чем окисление алюминия кислородом. Например, известная всем
"марганцовка" – марганцевокислый калий KMnO4 –
является сильным окислителем за счет атома Mn в степени окисления +7. Даже
анион хлора Cl– отдает ему электрон, превращаясь в атом хлора.
Это иногда используют для получения газообразного хлора в лаборатории:
+7
|
–1
|
0
|
+2
|
|||||||||
KMnO4
|
+
|
KCl
|
+
|
H2SO4
|
=
|
Cl2
|
+
|
MnSO4
|
+
|
K2SO4
|
+
|
H2O
|
Составим схему электронного баланса:
Двойка и пятерка – главные коэффициенты уравнения,
благодаря которым удается легко подобрать все другие коэффициенты. Перед Cl2 следует
поставить коэффициент 5 (или 2·5 = 10 перед KСl), а перед KMnO4 –
коэффициент 2. Все остальные коэффициенты привязывают к этим двум
коэффициентам. Это гораздо легче, чем действовать простым перебором чисел.
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
Чтобы уравнять количество атомов К (12 атомов слева), надо перед K2SO4 в
правой части уравнения поставить коэффициент 6. Наконец, чтобы уравнять
кислород и водород, достаточно перед H2SO4 и H2O
поставить коэффициент 8. Мы получили уравнение в окончательном виде.
Метод электронного баланса, как мы видим, не исключает и обыкновенного
подбора коэффициентов в уравнениях окислительно-восстановительных реакций, но
может заметно облегчить такой подбор.
**
Окислительно-восстановительные реакции играют огромную роль в природе и
технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ,
синтез растениями клетчатки из углекислого газа и воды – все это
окислительно-восстановительные процессы.
В
технике с помощью реакций этого типа получают такие важные вещества как
аммиак (NH3), серную (H2SO4)и
соляную (HCl) кислоты и многие другие продукты. Вся металлургия
основана на восстановлении металлов из их соединений – руд.
Большинство химических реакций – окислительно-восстановительные.
Приведем важнейшие определения, связанные с окислительно-восстановительными
реакциями.
Реакции,
протекающие с изменением степени окисления атомов, входящих в состав
реагирующих веществ, называются окислительно-восстановительными.
Окислителями
называются вещества, присоединяющие электроны. Во время
реакции они восстанавливаются.
Восстановителями
называются вещества, отдающие электроны. Во время реакции они
окисляются.
Поскольку окислитель
присоединяет электроны, степень окисления его атомов может только уменьшаться.
Наоборот, восстановитель теряет электроны и степень окисления его атомов должна
повышаться.
Окисление
всегда сопровождается восстановлением и, наоборот, восстановление всегда
связано с окислением.
Число
электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых
окислителем.
Если
каждый атом окислителя может принять иное количество электронов, чем отдает
атом восстановителя, то необходимо так подобрать количество атомов того и
другого реагента, чтобы количество отдаваемых и принимаемых электронов стало
одинаковым. Это требование положено в основу метода электронного баланса, с помощью
которого уравнивают уравнения окислительно-восстановительных реакций.
Различают
три основных типа окислительно-восстановительных реакций:
1) Реакции МЕЖМОЛЕКУЛЯРНОГО окисления-восстановления
(когда окислитель и восстановитель – разные вещества);
2) Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда
окислителем и восстановителем может служить одно и то же вещество);
3) Реакции ВНУТРИМОЛЕКУЛЯРНОГО окисления-восстановления
(когда одна часть молекулы выступает в роли окислителя, а другая – в
роли восстановителя).
Классификация окислительно-восстановительных
реакций
Межмолекулярные
окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами
в этих реакциях происходит между различными атомами или молекулами:
S0 + O20 → S+4O2-2
S -
восстановитель; O2 - окислитель
Cu+2O + C+2O → Cu0 + C+4O2
CO -
восстановитель; CuO - окислитель
Zn0 + 2HCl → Zn+2Cl2 + H20
Zn -
восстановитель; HСl - окислитель
Mn+4O2 +
2KI-1 + 2H2SO4 → I20 +
K2SO4 + Mn+2SO4 + 2H2O
KI - восстановитель; MnO2 - окислитель.
Сюда же относятся реакции между веществами, в которых атомы одного и того
же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 → 3S0 + 3H2O
Внутримолекулярные окислительно- восстановительные
реакции
Во внутримолекулярных реакциях окислитель и восстановитель
находятся в одной и той же молекуле. Внутримолекулярные
реакции протекают, как правило, при термическом разложении веществ,
содержащих окислитель и восстановитель.
2KCl+5O3-2 → 2KCl-1 + 3O20
Cl+5 -
окислитель; О-2 - восстановитель
N-3H4N+5O3 –t°→ N2+1O + 2H2O
N+5 -
окислитель; N-3 - восстановитель
2Pb(N+5O3-2)2 → 2PbO
+ 4N+4O2 + O20
N+5 - окислитель; O-2 - восстановитель
Опыт. Разложение
дихромата аммония
(N-3H4)2Cr2+6O7 –t°→ Cr2+3O3 +
N20 + 4H2O
Cr+6 - окислитель; N-3 - восстановитель.
Диспропорционирование -
окислительно-восстановительная реакция, в которой один элемент одновременно
повышает и понижает степень окисления.
Cl20 + 2KOH → KCl+1O + KCl-1 + H2O
3K2Mn+6O4 + 2H2O → 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 → HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH →KN+5O3 + KN+3O2 + H2O
Составление уравнений окислительно-восстановительных
реакций
A Электронный
баланс - метод нахождения коэффициентов в уравнениях
окислительно-восстановительных реакций, в котором рассматривается обмен
электронами между атомами элементов, изменяющих свою степень окисления. Число электронов,
отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 +
HCl → KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над
знаками элементов, которые меняются.
KMn+7O4 +
HCl-1 → KCl + Mn+2Cl2 + Cl20 +
H2O
3. Выделяют элементы, изменяющие степени
окисления и определяют число электронов, приобретенных окислителем и отдаваемых
восстановителем.
Mn+7 + 5ē → Mn+2
2Cl-1 - 2ē →Cl20
4. Уравнивают число приобретенных и
отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в
которых присутствуют элементы, изменяющие степень окисления.
Mn+7 + 5ē → Mn+2
|
2
|
2Cl-1 - 2ē → Cl20
|
5
|
––––––––––––––––––––––––
2Mn+7 +
10Cl-1 → 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех
остальных участников реакции.
2KMn+7O4 +
16HCl-1 → 2KCl + 2Mn+2Cl2 + 5Cl20 +
8H2O
B Электронно-ионный
баланс (метод полуреакций) метод нахождения коэффициентов, в котором рассматривается
обмен электронами между ионами в растворе с учетом характера среды:
2Cl1- – 2ē →
|
Cl20
|
5
|
|
MnO41- + 8H+
|
+ 5ē →
|
Mn2+ +
4H2O
|
2
|
7+
|
2+
|
––––––––––––––––––––––––––––––––––––––
10Cl- +
2MnO41- + 16H+ →5Cl20 +
2Mn2+ + 8H2O
(для уравнивания ионной
полуреакции используют H+, OH- или воду)
Типичные реакции
окисления-восстановления
Реакции с участием
перманганата калия в качестве окислителя
При
взаимодействии перманганата калия с восстановителем образуются различные
продукты восстановления в зависимости от pH среды.
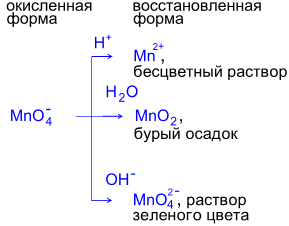
Реакции в кислой среде.
5K2S+4O3 + 2KMn+7O4 + 3H2SO4 ® 6K2S+6O4 + 2Mn+2SO4 + 3H2O
электронный
баланс
Mn+7 + 5ē ® Mn+2
|
2
|
S+4 –
2ē ® S+6
|
5
|
метод полуреакций
MnO4- + 8H+ + 5ē ® Mn2+ + 4H2O
|
2
|
SO32- + H2O – 2ē ® SO42- + 2H+
|
5
|
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O ® 2Mn2+ + 8H2O + 5SO42- + 10H+
или 2MnO4- + 6H+ + 5SO32- ® 2Mn2+ + 3H2O + 5SO42-
Фиолетовый
раствор KMnO4 обесцвечивается
при добавлении раствора K2SO3.
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O ® 3K2S+6O4 +2Mn+4O2¯ + 2KOH
электронный
баланс
S+4 – 2ē ® S+6
|
3
|
Mn+7 +
3ē ® Mn+4
|
2
|
метод полуреакций:
MnO41- + 2H2O + 3ē ® MnO2 + 4OH-
|
2
|
SO32- + 2OH- - 2ē ® SO42- + H2O
|
3
|
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- ® 2MnO2 + 8OH- + 3SO42- + 3H2O
или 2MnO4- + H2O + 3SO32- ® 2MnO2 + 2OH- + 3SO42-
Фиолетовый
раствор KMnO4 после
окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в щелочной среде.
K2S+4O3 + 2KMn+7O4 + 2KOH ® K2S+6O4 +2K2Mn+6O4 + H2O
электронный
баланс
S+4 – 2ē ® S+6
|
1
|
Mn+7 +
1ē ® Mn+6
|
2
|
метод полуреакций:
SO32- + 2OH- - 2ē ® SO42- + H2O
|
1
|
MnO41- + ē ® MnO42-
|
2
|
–––––––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- ® SO42- + H2O + 2MnO42-
Фиолетовый
раствор KMnO4 превращается
в зеленоватый раствор K2MnO4.
Таким образом,
1. Подберите коэффициенты в уравнении
окислительно-восстановительной реакции: Fe2O3 + CO → Fe + CO2
Решение: Fe2O3 + 3 CO = 2 Fe +3
CO2
FeIII + 3 e- = Fe0 2
CII - 2 e- = CIV 3
При одновременном окислении (или восстановлении) атомов
двух элементов одного вещества расчет ведут на одну формульную единицу этого
вещества.
_____________________________________________________________
2. Подберите коэффициенты в уравнении окислительно-восстановительной
реакции: Fe(S)2 + O2 = Fe2O3 + SO2
Решение: 4 Fe(S)2 +
11 O2 = 2 Fe2O3 + 8 SO2
FeII - e- = FeIII
-11 e- 4
2S-I - 10 e- =
2SIV
O20 + 4 e- = 2O-II + 4 e- 11
_____________________________________________________________
3. Подберите коэффициенты в уравнении реакции
окисления-восстановления: (NH4)2CrO4 → Cr2O3 + N2 +H2O + NH3
Решение: 2 (NH4)2CrO4 = Cr2O3 + N2 +5 H2O + 2 NH3
CrVI + 3 e- = CrIII 2
2N-III - 6 e- = N20 1
Для реакций дисмутации (диспропорционирования,
самоокисления - самовосстановления), в которых атомы одного и того же
элемента в реагенте окисляются и восстанавливаются, дополнительные множители
проставляют вначале в правую часть уравнения, а затем находят коэффициент для
реагента.
_____________________________________________________________
4. Подберите коэффициенты методом электронно-ионного
баланса в уравнении окислительно-восстановительной реакции:
Na2SO3 +
KOH + KMnO4 → Na2SO4 + H2O
+ K2MnO4
Решение: Na2SO3 + 2 KOH + 2 KMnO4 = Na2SO4 + H2O +
2 K2MnO4
SO32- + 2 OH- + 2 MnO4- = SO42- + H2O +
2 MnO42-
MnO4- + 1 e- = MnO42- 2
SO32- + 2 OH- -2 e- = SO42- + H2О 1
Если
перманганат-ион используется в качестве окислителя в слабокислотной среде, то
уравнение полуреакции восстановления:
MnO4- + 4 H+ + 3 e- = MnО2(т) + 2 H2O
а
если в слабощелочной среде, то
MnO4- + 2 H2О + 3 e- = MnО2(т) + 4 ОН-
Часто слабокислую и слабощелочную среду условно называют
нейтральной, при этом в уравнения полуреакций слева
вводят только молекулы воды. В этом случае при составлении уравнения следует
(после подбора дополнительных множителей) записать дополнительное уравнение,
отражающее образование воды из ионов Н+ и ОН-.
_____________________________________________________________
5. Подберите коэффициенты в уравнении реакции,
протекающей в нейтральной среде:
KMnO4 + H2О + Na2SO3 → MnО2(т) + Na2SO4…..
Решение: 2 KMnO4 + H2О +
3 Na2SO3 = 2 MnО2(т) + 3 Na2SO4 + 2 КОН
MnO4- + H2О+ 3 SO32- = 2 MnО2(т) + 3 SO42- + 2ОН-
MnO4- + 2 H2О + 3 e- = MnО2(т) + 4 ОН-
SO32- + H2O -2 e- = SO42- + 2 H+
8ОН- + 6 Н+ = 6 Н2О + 2 ОН-
Таким образом, если реакцию из примера 10
проводят простым сливанием водных растворов перманганата калия и сульфита
натрия, то она протекает в условно нейтральной (а в действительности, в
слабощелочной) среде из-за образования гидроксида калия. Если же раствор перманганата калия
немного подкислить, то реакция будет протекать в слабокислотной (условно
нейтральной) среде.
_____________________________________________________________
Решение: 2KMnO4 + H2SO4 + 3Na2SO3 = 2MnО2(т) + H2O +
3Na2SO4 + K2SO4
2 MnO4- + 2 H++
3 SO32- = 2 MnО2(т) + Н2О + 3 SO42-
MnO4- + 4 H+ + 3 e- = MnО2(т) + 2 H2O 2
SO32- + H2O - 2 e- = SO42- + 2 H+ 3
Формы существования окислителей и
восстановителей до и после реакции, т.е. их окисленные и восстановленные формы,
называют окислительно-восстановительными
парами. Так, из
химической практики известно (и это требуется запомнить), что перманганат-ион в
кислотной среде образует катион марганца(II) (пара MnO4- + H+ / Mn2+ + H2O), в слабощелочной среде - оксид марганца(IV) (пара MnO4-+ H+ ¤ MnО2(т) + H2O или MnO4-+ H2О = MnО2(т) + ОН-). Состав окисленных и
восстановленных форм определяется, следовательно, химическими свойствами
данного элемента в различных степенях окисления, т.е. неодинаковой
устойчивостью конкретных форм в различных средах водного раствора.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Расставьте
коэффициенты в УХР методом электронного баланса, укажите процессы окисления
(восстановления), окислитель (восстановитель); запишите реакции в полном и
ионном виде:
А) Zn + HCl = H2+
ZnCl2
Б) Fe + CuSO4 = FeSO4 + Cu
2. Даны схемы уравнений реакций:
СuS + HNO3(разбавленная) = Cu(NO3)2 + S + NO + H2O
СuS + HNO3(разбавленная) = Cu(NO3)2 + S + NO + H2O
K + H2O = KOH + H2
Расставьте коэффициенты в реакциях используя метод электронного баланса.
Укажите вещество - окислитель и вещество - восстановитель.
3. С помощью метода электронного баланса
подберите коэффициенты в уравнениях окислительно-восстановительных реакций:Расставьте коэффициенты в реакциях используя метод электронного баланса.
Укажите вещество - окислитель и вещество - восстановитель.
1) NH3 + O2 = NO + H2O
2) PH3 + Cl2 = PCl3 + HCl
3) CH4 + Cl2 = CCl4 + HCl
4) CuO + NH3 = Cu + N2 + H2O
5) P + N2O = N2 + P2O5
6) NO2 + H2O = HNO3 + NO
7) NH4NO3 = N2O + H2O
4. Уравняйте
следующие реакции:
1) KMnO4 + K2SO3 + H2SO4 = MnSO4 + K2SO4 + H2O
2) KMnO4 + K2SO3 + H2O = MnO2 + K2SO4 + KOH
3) KMnO4 + K2SO3 + KOH = K2MnO4 + K2SO4 + H2O
4) KMnO4 + H2S + H2SO4 = MnSO4 + K2SO4 + S + H2O
5) K2Cr2O7 + SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
6) K2Cr2O7 + KI + H2SO4 = Cr2(SO4)3 + K2SO4 + I2 + H2O
7) KMnO4 + HCl = Cl2↑ + MnCl2 + KCl + H2O
5. Перекись водорода способна быть как окислителем, так и
восстановителем. Найдите окислитель и восстановитель в следующих реакциях и
уравняйте их:1) KI + H2O2 = I2 + KOH
2) I2 + H2O2 = HIO3 + H2O
2) HClO + H2O2 = HCl + O2 + H2O
6. Уравняйте следующие реакции:
1) K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + K2SO4 + S + H2O
2) K2MnO4 + H2O = MnO2 + KMnO4 + KOH
3) NaBr + H2SO4 + NaBrO3 = Br2 + Na2SO4 + H2O
4) (NH4)2Cr2O7 = Cr2O3 + N2↑ + H2O
Чем отличаются эти реакции и как они называются?
7. Какие из следующих реакций являются
окислительно-восстановительными:
9. Укажите тип каждой из следующих
окислительно-восстановительных реакций:
Какую роль
(окислителя; восстановителя; и
окислителя, и восстановителя) играет
пероксид водорода в каждой из этих реакций. Составьте уравнения реакций методом
электронного баланса.
|
1.
Отметьте схемы ОВР:
|
|
|
а) SiH4+ O2 → SiO2 +
H2O
|
б) FeO + P → Fe + P2O5
|
|
в) все ответы
верны
|
г) Ca + H2 → CaH2
|
|
2.
Окислительные свойства простых веществ слева
направо возрастают в рядах:
|
|
|
а) хлор, бром, фтор
|
б) бром, цинк, фтор
|
|
в) сера, водород, кислород
|
г) углерод, азот, кислород
|
|
3.
Найдите сумму коэффициентов перед всеми веществами
в ОВР, протекающей по схеме Fe + H2O + O2 → Fe (OH)3:
|
|
|
а) 12
|
б) 13
|
|
в) 15
|
г) 17
|
|
4.
Какие свойства в ОВР проявляет йодид-ион:
|
|
|
а) только окислителя
|
б) ни окислителя, ни восстановителя
|
|
в) только восстановителя
|
г) и окислителя, и восстановителя
|
|
5.
Двойственные окислительно-восстановительные
свойства в ОВР характерны для:
|
|
|
а) оксида серы (IV)
|
б) азотной кислоты
|
|
в) азотистой кислоты
|
г) перманганата калия
|
|
6.
Укажите наименьшее общее кратное чисел отданных и
принятых электронов для ОВР, протекающей по схеме FeS2 + O2 → Fe2O3 + SO2:
|
|
|
а) 4
|
б) 40
|
|
в) 44
|
г) 20
|
|
7.
Укажите сумму коэффициентов при формулах всех
веществ для ОВР, протекающей по схеме Fe + HNO3 → Fe(NO3)3 +
NO + H2O:
|
|
|
а) 5
|
б) 6
|
|
в) 9
|
г) 7
|
|
8.
Укажите значение коэффициента при окислении в ОВР,
протекающей по схеме Р + КСlO3 → КСl + P2O5
|
|
|
а) 6
|
б) 3
|
|
в) 5
|
г) 11
|
|
9.
Укажите значение коэффициента при окислении в ОВР,
протекающей по схеме P + HNO3 + H2O → H3PO4 + NO:
|
|
|
а) 10
|
б) 18
|
|
в) 8
|
г) 9
|
|
10.
Укажите
сумму коэффициентов перед формулами всех веществ в ОВР, отражаемой
схемой KMnO4 + HCl → KCl
+ MnCl2 + Cl2
+
H2O:
|
|
|
а) 18
|
б) 25
|
|
в) 30
|
г) 35
|
Ответы:
|
1
|
в
|
|
2
|
г
|
|
3
|
г
|
|
4
|
в
|
|
5
|
а
|
|
6
|
в
|
|
7
|
в
|
|
8
|
в
|
|
9
|
в
|
|
10
|
г
|








Комментариев нет:
Отправить комментарий