8.10.
Кремний и его важнейшие соединения
Несмотря на распространенность в природе,
элементарный кремний открыли довольно поздно, в
1825 г. Шведский химик Йенс Якоб Берцелиус выделил
не очень чистый аморфный кремний коричневого цвета. Для этого он восстановил
металлическим калием тетрафторид кремния. Элемент назван от латинского слова
«силекс» – кремень.
Место кремния в Периодической системе
химических элементов
Д.И. Менделеева
На внешнем энергетическом уровне атома
углерода содержится 4 электрона, которые имеют электронную конфигурацию 3s23p2. Кремний проявляет
степени окисления -4, +2, +4. Кремний – типичный неметалл, в зависимости от
типа превращения элемент может быть окислителем и восстановителем.
Строение атома кремния
в основном состоянии
1s22s22p63s23p2
|
Строение атома кремния в
возбуждённом состоянии
1s22s22p63s13p3
Степени
окисления: +4, -4.
|
Распространенность в
природе
Кремний – второй
по распространенности элемент на Земле после кислорода. Его содержание в земной
коре составляет 27,6 % (мас.). Встречается только в виде соединений. Оксид
кремния образует большое количество природных веществ – горный хрусталь, кварц,
кремнезем. Составляет основу многих полудрагоценных камней – агат, аметист,
яшма и др. Также кремний входит в состав породообразующих минералов – силикатов
и алюмосиликатов – полевых шпатов, глин, слюд и др.
Физические свойства
кремния
Кремний
образует две аллотропные модификации – аморфный и кристаллический кремний.
Кристаллический
кремний – вещество темно-серого цвета с металлическим блеском, имеет кубическую
структуру алмаза, но значительно уступает ему по твердости, довольно хрупок.
Температура плавления 1415 °C, температура кипения 2680 °C, плотность
2,33 г/см3. Обладает полупроводниковыми свойствами, его
сопротивление понижается при повышении температуры.
Аморфный кремний
– порошок бурого цвета на основе сильно разупорядоченной алмазоподобной
структуры. Обладает большей реакционной способностью, чем кристаллический
кремний.
Аллотропия
кремния
Известен аморфный и кристаллический
кремний.
Поликристаллический кремний
Кристаллический – тёмно-серое вещество с
металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см3,
t°пл. =1415°C; t°кип. = 2680°C.
Имеет алмазоподобную структуру и образует прочные
ковалентные связи. Инертен.
Аморфный - бурый порошок, гигроскопичен, алмазоподобная
структура, ρ = 2 г/см3, более реакционноспособен.
Получение
кремния
1) Промышленность – нагревание угля с песком:
2C + SiO2 t˚→ Si + 2CO
2Mg + SiO2 t˚→ Si +
2MgO
Химические
свойства
Типичный неметалл, инертен.
Как восстановитель:
1)
С кислородом
Si0 + O2 t˚→ Si+4O2
2)
С фтором (без нагревания)
Si0 + 2F2 → SiF4
3)
С углеродом
Si0 + C t˚→ Si+4C
(SiC - карборунд - твёрдый; используется для точки и
шлифовки)
4)
С водородом не взаимодействует.
Силан (SiH4) получают разложением силицидов
металлов кислотой:
Mg2Si + 2H2SO4 →
SiH4 + 2MgSO4
5)
С кислотами не реагирует (только с плавиковой кислотой Si+4HF=SiF4+2H2)
Растворяется только в смеси азотной и плавиковой
кислот:
3Si + 4HNO3 +
18HF → 3H2[SiF6] + 4NO + 8H2O
6)
Со щелочами (при нагревании):
Как окислитель:
7)
С металлами (образуются силициды):
Si0 + 2Mg t˚→ Mg2Si-4
Применение
кремния
Кремний широко используется в электронике как
полупроводник. Добавки кремния к сплавам повышают их коррозионную стойкость.
Силикаты, алюмосиликаты и кремнезем – основное сырье для производства стекла и
керамики, а также для строительной промышленности.
Силан - SiH4
Физические свойства: Бесцветный газ, ядовит, t°пл.
= -185°C, t°кип. = -112°C.
Химические
свойства:
1)
Окисление: SiH4 + 2O2 t˚→ SiO2 +
2H2O
2)
Разложение: SiH4 → Si + 2H2
Оксид кремния (IV) - (SiO2)n
Кристаллическая
решётка оксида кремния (IV) – атомная и имеет такое строение:
Al2O3 • 2SiO2 •
2H2O - каолинит (основная часть глины)
K2O • Al2O3 •
6SiO2 - ортоклаз (полевой шпат)
Физические свойства: Твёрдое, кристаллическое,
тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C
Химические свойства:
Кислотный
оксид. При сплавлении взаимодействует с основными оксидами, щелочами, а
также с карбонатами щелочных и щелочноземельных металлов:
1)
С основными оксидами:
SiO2 +
CaO t˚→ CaSiO3
2)
Со щелочами:
SiO2 +
2NaOH t˚→ Na2SiO3 +
H2O
3) С
водой не реагирует
4)
С солями:
SiO2 + CaCO3 t˚→ CaSiO3 +
CO2
SiO2 + K2CO3 t˚→ K2SiO3 +
CO2
5)
С плавиковой кислотой:
SiO2 +
4HF t˚→ SiF4 + 2H2O
SiO2 +
6HF t˚→ H2[SiF6] (гексафторкремниевая
кислота) + 2H2O
(реакции
лежат в основе процесса травления стекла).
Применение:
1.
Изготовление силикатного кирпича
2.
Изготовление керамических изделий
3. Получение
стекла
Кремниевые
кислоты
x • SiO2 • y H2O
x = 1, y = 1 H2SiO3 -
метакремниевая кислота
x = 1, y = 2 H4SiO4 -
ортокремниевая кислота и т.д.
Физические свойства: H2SiO3 -
очень слабая (слабее угольной), непрочная, в воде малорастворима (образует
коллоидный раствор), не имеет кислого вкуса.
Получение:
Действие сильных кислот на силикаты - Na2SiO3 +
2HCl → 2NaCl + H2SiO3↓
Химические свойства:
При нагревании разлагается: H2SiO3 t˚→
H2O + SiO2
Соли кремниевой кислоты - силикаты.
1) с кислотами
Na2SiO3+H2O+CO2=Na2CO3+H2SiO3
2) с солями
Na2SiO3+CaCl2=2NaCl+CaSiO3↓
3) Силикаты, входящие в состав
минералов, в природных условиях разрушаются под действием воды и оксида
углерода (IV) - выветривание горных пород:
(K2O • Al2O3 •
6SiO2)(полевой шпат) + CO2 +
2H2O → (Al2O3 • 2SiO2 •
2H2O)(каолинит (глина)) + 4SiO2(кремнезём (песок)) + K2CO3
Применение
соединений кремния
Природные соединения кремния - песок
(SiO2) и силикаты используются для производства керамики, стекла и
цемента.
Керамика
|
|
|
Фарфор = каолин+ глина + кварц +
полевой шпат. Родина фарфора – Китай, где фарфор известен уже в 220г. В 1746
г – налажено производство фарфора в России
|
Фаянс
- от
названия итальянского города Фаэнца. Где в 14-15веках было развито
керамическое ремесленничество. Фаянс – отличается от фарфора большим
содержанием глины (85%), более низкой температурой обжига.
|
Стекло – хрупкий, прозрачный материал,
способен размягчаться и при застывании принимает любую форму. Стекло получают
варкой шихты (сырьевой смеси, состоящей из песка, соды и
известняка) в специальных стекловаренных печах.
Основные реакции, протекающие при плавке шихты
1. Na2CO3 +
SiO2 = Na2SiO3 + CO2
2. CaCO3 + SiO2 = CaSiO3 + CO2
3. Na2SiO3 + CaSiO3 + 4SiO2 = Na2O * CaO * 6SiO2 - формула оконного стекла
2. CaCO3 + SiO2 = CaSiO3 + CO2
3. Na2SiO3 + CaSiO3 + 4SiO2 = Na2O * CaO * 6SiO2 - формула оконного стекла
При добавлении оксида свинца получают хрусталь.
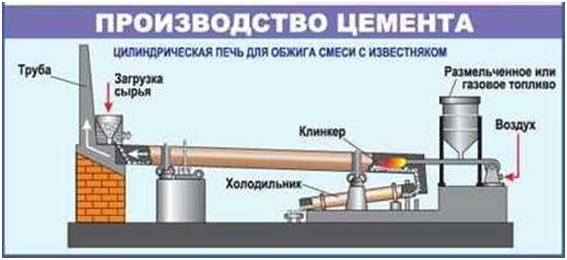
Цемент
Цемент – мелко измельчённый клинкер с
минеральными добавками.
Клинкер - шарики тёмно-серого цвета
получают спеканием глины и известняка в специальных вращающихся печах.
УПРАЖНЕНИЯ
1. Запишите уравнения реакций,
при помощи которых можно осуществить следующие превращения: Si → SiCl4 → Si → SiO2 → Si → K2SiO3.
Решение:
Кремний реагирует с хлором при нагревании
до 400–600 °С, образуя тетрахлорид кремния:
Si + 2Cl2 = SiCl4.
Кремний образуется при восстановлении
тетрахлорида кремния водородом при 1200 °С:
SiCl4 + 2H2 = Si + 4HCl.
Измельченный кремний при нагревании до
400–600 °С реагирует с кислородом:
Si + O2 = SiO2.
При восстановлении оксида кремния (IV)
коксом в электрических печах образуется кремний:
SiO2 + 2C = Si + 2CO.
Кремний растворяется в щелочах, образуя
силикат и водород:
Si +
2KOH + H2O = K2SiO3 + 2H2.
________________________________________________________________
2. При
восстановлении 30 г оксида кремния (IV) водородом получили кремний.
Вычислите объем раствора гидроксида натрия с массовой долей NaOH 40 %
(плотность раствора 1,44 г/мл), необходимый для растворения кремния.
Решение:
Запишем уравнения протекающих реакций:
SiO2 +
2H2 = Si + 2H2O,
(1)
Si + 2NaOH + H2O
= Na2SiO3 +
2H2.
(2)
Для определения объема гидроксида натрия, необходимого
для растворения получившегося кремния, нужно знать его количество. Для
определения количества кремния вычислим количество прореагировавшего оксида
кремния (IV):
(моль).
По уравнению реакции (1) из 1 моль оксида кремния (IV)
образуется 1 моль кремния, следовательно, из 0,5 моль оксида кремния (IV)
образуется 0,5 моль кремния.
По уравнению реакции (2) на растворение 1 моль кремния
нужно 2 моль гидроксида натрия, то есть соотношение n (Si) : n (NaOH) = 1 : 2,
поэтому на растворение 0,5 моль кремния необходимо 1 моль гидроксида натрия.
Вычислим массу 1 моль гидроксида натрия:
m (NaOH) = n (NaOH) · M (NaOH) = 1 · 40 = 40 (г).
Массу раствора найдем из определения массовой доли
растворенного вещества:
.
Объем раствора связан с его массой и плотностью
соотношением:
.
Подставим имеющиеся значения в формулы и найдем объем
40 %-ного раствора гидроксида натрия, необходимый для растворения кремния:
(г);
(мл).
Ответ: V(р-ра NaOH) = 69,4 мл.
________________________________________________________________
3. При взаимодействии углерода с концентрированной серной кислотой выделилось 13,44 л смеси двух газов (н.у.).Рассчитайте массу углерода, вступившего в реакцию.
Решение:
Пусть в реакцию
С + 2Н2SО4(конц) = СО2↑
+ 2SО2↑ + 2Н2О
вступило х моль С, тогда образовалось х моль СО2 и 2х моль SО2, всего Зх моль газов. По условию, количество газов в смеси
равно13,44/22,4 = 0,6 = Зх, откуда х = 0,2. Масса углерода равна 0,2.12 = 2,4 г.
Ответ. 2,4 г С.
________________________________________________________________
4. При полном гидролизе смеси карбидов кальция
алюминия образуется смесь газов, которая в 1,6 раза легче кислорода.Определите массовые доли карбидов в исходной смеси.
Решение:
В результате гидролиза образуются метан и ацетилен:
Аl4С3 +
12Н2О = 4Аl(ОН)3 + 3СН4↑,
СаС2 +
2Н2О = Са(ОН)2 + С2Н2↑.
Пусть в исходной смеси содержалось х моль Аl4С3 и у моль СаС2, тогда в газовой смеси содержится 3х моль СН4 и у моль С2Н2.Средняя молярная масса газовой смеси равна:
Мср = M(О2) / 1,6 = 20 =
(3x.16 + у.26)
/ (3х+у), откуда у = 2х.
Массовые доли карбидов в исходной смеси равны:
ω(Аl4С3) = 144x / (144х+64у) • 100% = 52,94%,
ω(CаС2)
= 64у / (144х+64у) • 100%
= 47,06%.
Ответ. 52,94% Аl4С3, 47,06% СаС2.
________________________________________________________________
5. При взаимодействии сложного вещества “А” с избытком магния при нагревании образуются два вещества, одно из которых —“В” — под действием соляной кислоты выделяет ядовитый газ “С”. При сжигании газа “С” образуются исходное вещество “А” и вода.Назовите вещества “А”, “В” и “С”. Напишите
уравнения перечисленных химических реакций.
Решение: Вещество “А” — оксид кремния, SiO2. При взаимодействии SiO2 с магнием сначала образуется кремний, который
реагирует с избытком магния и образует силицид кремния, Mg2Si ( (вещество “В”):
SiO2 + 4Mg = Мg2Si + 2MgО.
Силицид магния легко гидролизуется с образованием ядовитого
газа силана, SiН4 (вещество “С”):
Mg2Si + 4НСl = SiН4↑ + 2MgCl2.
При сгорании силана образуются исходное вещество SiO2 и вода:
SiН4 +
2О2 = SiO2 +
2Н2О.
________________________________________________________________
6. Смесь кремния и угля, массой 5,0 г, обработали избытком концентрированного раствора щелочи при нагревании. В
результате реакции выделилось 2,8 л водорода (н.у.). Вычислите
массовую долю углерода в этой смеси.
Решение:
С раствором щелочи реагирует только кремний:
Si + 2NаОН + Н2О
= Na2SiO3 +
2Н2↑.
v(Н2) = 2,8/22,4 = 0,125 моль. v(Si) = 0,125/2 = 0,0625 моль. m(Si) = 0,025.28 = 1,75 г. m(С)
= 5,0-1,75 = 3,25 г. Массовая доля углерода равна: ω(С) =
3,25/5,0 = 0,65, или 65%.
Ответ. 65% С.
________________________________________________________________
7. При сплавлении гидроксида натрия и оксида кремния (IV) выделилось 4,5 л водяных паров (измерено при 100 °С и 101 кПа).Какое количество силиката натрия при этом образовалось?
Решение:
При сплавлении происходит реакция:
2NаОН + SiO2 = Na2SiO3 + Н2О↑.
Количество выделившейся воды равно: v(Н2О) = РV / RТ = 101.4,5 / (8,31.373) =
0,147 моль.Количество образовавшегося Na2SiO3 также равно 0,147 моль.
Ответ. 0,147 моль Nа2SiO3.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Осуществите превращения по схеме:
1) Si → SiO2 →
Na2SiO3 → H2SiO3 →SiO2
2) Si → Mg2Si → SiH4 → SiO2
2.
Запишите уравнения реакций между кремнием и следующими веществами:
а) смесью
азотной и плавиковой кислот;
б)
гидроксидом натрия;
в)
фтороводородом;
г)
углеродом;
д) кальцием.
3.
Запишите уравнения реакций, при помощи которых можно осуществить следующие
превращения:
SiO2 → Si → Mg2Si → SiH4 → SiO2 → Na2SiO3 → H2SiO3.
Укажите
условия протекания реакций.
4.
Запишите уравнения реакций между следующими веществами:
а)
тетрахлоридом кремния и водородом;
б) силаном и
гидроксидом натрия;
в) оксидом
кремния (IV) и плавиковой кислотой;
г) оксидом
кремния (IV) и карбонатом натрия.
5.
При восстановлении кремнезема массой 300 г магнием образовалось 112 г кремния. Вычислите массовую долю
оксида кремния (IV) в кремнеземе.
6.
При восстановлении смеси 68,0 г оксида кремния (IV) и 80,0 г
оксида магния коксом в электропечи получили силицид магния. Вычислите объем
соляной кислоты с массовой долей HCl 36 % (плотность раствора 1,183 г/мл),
необходимый для растворения силицида.
7.
В трех пробирках имеются растворы силиката натрия, карбоната натрия и
сульфида калия. С помощью какого одного реактива можно определить каждый из
указанных растворов? Приведите уравнения соответствующих реакций.
8.
Так называемое нормальное стекло
содержит 13% оксида натрия, 11,7% оксида кальция и 75,3% оксида кремния (IV). Выразите
состав стекла формулой (в виде соединения оксидов).
9.
Имеется смесь кремния, графита и карбоната кальция. Найдите ее
количественный состав, если известно, что при обработке 34 г смеси раствором NaOH получено 22,4 л газа (н.у.), а при
обработке такой же порции смеси соляной кислотой получено 2,24 л газа (н.у.).
10.
Составьте уравнения реакций, с помощью которых можно осуществить следующие
превращения:
ВИДЕО ОПЫТ
1.
С какими веществами при определенных условиях
реагирует оксид кремния (IV):
|
|
а)
магнием
|
б) все ответы верны
|
в) углеродом
|
г) гидроксидом калия
|
2.
С какими веществами реагирует силикат калия:
|
|
а) водным раствором углекислого газа
|
б) соляной кислотой
|
в) известковой водой
|
г) все ответы верны
|
3.
Степень окисления кремния +4 равна в:
|
|
а) тетрахлориде кремния
|
б) каолините
|
в) все ответы верны
|
г) карборунде
|
4.
Чем различаются между собой атомы кремния и атомы
углерода:
|
|
а) зарядом ядра
|
б) все ответы верны
|
в) числом энергетических уровней
|
г) числом вакантных орбиталей на
внешнем энергетическом уровне
|
5.
Кремний может образоваться при взаимодействии:
|
|
а) силана с избытком кислорода
|
б) оксида кремния (IV) с магнием
|
в) нет верного ответа
|
г) оксида кремния с избытком кальция
|
6.
Соединение содержит по массе 70 % кремния и 30 %
углерода. Укажите его простейшую формулу:
|
|
а) SiC2
|
б) Si2C
|
в) SiC
|
г) Si3C2
|
7.
В реакциях с азотом и серой кремний проявляет
свойства:
|
|
а) окислителя
|
б) восстановителя
|
в) восстановителя в реакции с азотом,
окислителя в реакциях с серой и углеродом
|
г) окислителя в реакции с углеродом,
восстановителя в реакциях с азотом и серой
|
8.
Как кремнезем, так и оксид углерода (IV) реагируют с:
|
|
а) оксидом бария
|
б) все ответы верны
|
в) магнием
|
г) углеродом
|
9.
Что общего между оксидами кремния (IV) и углерода (IV):
|
|
а) все ответы верны
|
б) степень окисления атомов кремния и
углерода
|
в) валентность атомов кремния и
углерода
|
г) оба оксида солеобразующие
|
10.
Какую
суммарную массу (т) известняка, кремнезема и соды нужно взять, чтобы получить
1т обычного оконного стекла при выходе реакции 90 %:
|
|
а) 1,316
|
б) 1,184
|
в) 1,268
|
г) 1,415
|
Ответы:
1
|
б
|
2
|
г
|
3
|
в
|
4
|
б
|
5
|
б
|
6
|
в
|
7
|
б
|
8
|
б
|
9
|
а
|
10
|
а
|























Комментариев нет:
Отправить комментарий