10.4.
Карбоновые кислоты
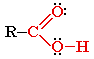
Карбоновые кислоты – это кислородсодержащие органически
вещества, молекулы которых содержат одну или несколько карбоксильных
групп
(-СOOH), соединённых с углеродным радикалом или водородным
атомом.
Карбоксильная
группа содержит две функциональные группы – карбонил >С=О и гидроксил -OH,
непосредственно связанные друг с другом:
Классификация
А) По числу карбоксильных групп в молекуле
Название
|
Примеры
|
1) Одноосновные
|
Метановая,
муравьиная кислота
Этановая, уксусная
кислота
|
2) Двухосновные
|
HOOC – COOH
Щавелевая кислота
|
|
3) Многоосновные
|
Б) По природе
углеводородного радикала
Название
|
Примеры
|
1) Предельные (насыщенные)
|
HCOOH
Метановая,
муравьиная кислота
CH3COOH
Этановая, уксусная кислота
|
2) Непредельные
|
Акриловая кислота
СН2=СНСООН
Кротоновая кислота
СН3–СН=СН–СООН
Олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН
Линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН
Линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН
|
3) Ароматические
|
С6Н5СООН
– бензойная кислота
НООС–С6Н4–СООН Пара-терефталевая
кислота
|
Изомерия и номенклатура
I. Структурная
А) Изомерия углеродного скелета
(начиная с C4)
Б) Межклассовая со сложными
эфирами R- CO – O- R1 (начиная с C2)
Например: для С3Н6О2
CH3-CH2-COOH пропионовая кислота
СH3-CO-OCH3 метиловый эфир уксусной
кислоты
II. Пространственная
А) Оптическая
Например:
Б) Цис-
транс – изомерия для непредельных кислот
Пример:
Номенклатура карбоновых кислот
Систематические
названия кислот даются по названию соответствующего углеводорода с добавлением
суффикса -овая и слова кислота.
Чтобы
указать положение заместителя (или радикала), нумерацию углеродной цепи
начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной
углеродной цепью (CH3)2CH-CH2-COOH
называется 3-метилбутановая кислота. Для органических кислот широко
используются также тривиальные названия, которые обычно отражают природный
источник, где были впервые обнаружены эти соединения.
Некоторые одноосновные кислоты
Формула
|
Название кислоты R-COOH
|
Название остатка RCOO-
|
|
систематическое
|
тривиальное
|
||
HCOOH
|
метановая
|
муравьиная
|
формиат
|
CH3COOH
|
этановая
|
уксусная
|
ацетат
|
C2H5COOH
|
пропановая
|
пропионовая
|
пропионат
|
C3H7COOH
|
бутановая
|
масляная
|
бутират
|
C4H9COOH
|
пентановая
|
валерьяновая
|
валерат
|
C5H11COOH
|
гексановая
|
капроновая
|
капрат
|
C15H31COOH
|
гексадекановая
|
пальмитиновая
|
пальмитат
|
C17H35COOH
|
октадекановая
|
стеариновая
|
стеарат
|
C6H5COOH
|
бензолкарбоновая
|
бензойная
|
бензоат
|
CH2=СH-COOH
|
пропеновая
|
акриловая
|
акрилат
|
Для многоосновных кислот применяют
суффиксы -диовая, -триовая и т.д.
Например:
HOOC-COOH
- этандиовая (щавелевая) кислота;
HOOC-CH2-COOH
- пропандиовая (малоновая) кислота.
ПРЕДЕЛЬНЫЕ
ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
CnH2n+1-COOH или CnH2nO2
Гомологический ряд
Название
|
Формула
кислоты
|
tпл.
°C |
tкип.
°C |
ρ
г/см3 |
|
кислоты
|
|||||
муравьиная
|
метановая
|
HCOOH
|
8,3
|
100,5
|
1,22
|
уксусная
|
этановая
|
CH3COOH
|
16,8
|
118
|
1,05
|
пропионовая
|
пропановая
|
CH3CH2COOH
|
-21
|
141
|
0,99
|
масляная
|
бутановая
|
CH3(CH2)2COOH
|
-6
|
164
|
0,96
|
Строение карбоксильной группы
Карбоксильная
группа сочетает в себе две функциональные группы – карбонил >C=O и
гидроксил -OH, взаимно
влияющие друг на друга:
Кислотные
свойства карбоновых кислот обусловлены смещением электронной плотности к
карбонильному кислороду и вызванной этим дополнительной (по сравнению со
спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость
в воде и высокие температуры кипения кислот обусловлены образованием
межмолекулярных водородных связей.
С
увеличением молекулярной массы растворимость кислот в воде уменьшается.
Физические свойства предельных одноосновных кислот
Низшие члены
этого ряда при обычных условиях представляют собой жидкости, обладающие
характерным острым запахом. Например, этановая (уксусная) кислота имеет
характерный "уксусный" запах. Безводная уксусная кислота при
комнатной температуре представляет собой жидкость; при 17 °С она замерзает,
превращаясь в льдистое вещество, которое получило название "ледяная"
уксусная кислота. Средние представители этого гомологического ряда — вязкие,
"маслообразные" жидкости; начиная с С10 — твердые
вещества.
Простейший представитель
– муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а
чистая безводная уксусная кислота CH3COOH при охлаждении до
16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее
название ледяная кислота).
Простейшая ароматическая кислота - бензойная C6H5COOH
(т. пл. 122,4°С) - легко возгоняется, т.е. переходит в газообразное состояние,
минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство
используется для очистки вещества от примесей.
Химические свойства карбоновых кислот
Карбоновые
кислоты проявляют высокую реакционную способность. Они вступают в реакции с
различными веществами и образуют разнообразные соединения, среди которых
большое значение имеют функциональные производные, т.е. соединения,
полученные в результате реакций по карбоксильной группе.
Названия солей составляют из названий остатка RCOO– (карбоксилат-иона)
и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca
– формиат кальция, C17H35COOK – стеарат калия и т.п.
I. Общие с другими кислотами
1. Диссоциация:
R-COOH ↔ RCOO- + H+
-Сила кислот уменьшается в ряду:
H-COOH > CH3-COOH > CH3-CH2-COOH
2. Взаимодействие с
активными металлами:
2R-COOH + 2Na → 2R-COONa + H2↑
3. Взаимодействие с
основными оксидами и основаниями:
2R-COOH + CaO → (R-COO)2Ca + H2O
R-COOH + NaOH → R-COONa + H2O
4. Взаимодействие с
солями слабых кислот:
R-COOH + NaHCO3 → R-COONa + H2O + CO2↑
Соли карбоновых кислот разлагаются сильными
минеральными кислотами:
R-COONa + HСl → NaCl + R-COOH
-В водных растворах гидролизуются:
R-COONa + H2O ↔ R-COOH + NaOH
5. Образование сложных
эфиров со спиртами:
II. Специфические свойства
1. Образование
функциональных производных R-CO-X
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
2. Образование амидов
CH3COOH + NH3→CH3COONH4 t˚C→
CH3CONH2 + H2O
Вместо карбоновых кислот чаще
используют их галогенангидриды:
Амиды
образуются также при взаимодействии карбоновых кислот (их галогенангидридов или
ангидридов) с органическими производными аммиака (аминами):
Амиды играют
важную роль в природе. Молекулы природных пептидов и белков построены из
a-аминокислот с участием амидных групп - пептидных связей.
3. Реакции замещения с
галогенами
(свойства
углеводородного радикала, образуется а-хлорпроизводное карбоновой
кислоты ):
4. Особенности
муравьиной кислоты H-COOH:
· Даёт реакцию «Серебряного зеркала»:
H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O
· Окисление хлором:
H-COOH + Cl2 → CO2 + 2HCl
· Вступает
в реакцию с гидроксидом меди(II):
H-COOH
+ 2Cu(OH)2 t → Cu2O↓ + CO2↑
+ 3H2O
· Разлагается при нагревании:
HCOOH t,H2SO4→ CO↑ + H2O
5. Реакции декарбоксилирования
солей карбоновых кислот
(получение алканов):
R-COONa + NaOH t → Na2CO3 + R-H (алкан)
6. Окисление в
атмосфере кислорода:
R-COOH + O2 → CO2 + H2O
Получение карбоновых кислот
I. В промышленности
1. Выделяют из
природных продуктов
(жиров, восков, эфирных и
растительных масел)
2. Окисление алканов:
2CH4 + + 3O2 t,kat → 2HCOOH + 2H2O
метан муравьиная кислота
2CH3-CH2-CH2-CH3 + 5O2 t,kat,p → 4CH3COOH
+ 2H2O
н-бутан уксусная
кислота
3. Окисление алкенов:
CH2=CH2 + O2 t,kat →
CH3COOH
этилен
СH3-CH=CH2 +
4[O] t,kat → CH3COOH
+ HCOOH (уксусная кислота+муравьиная кислота)
4. Окисление гомологов
бензола (получение бензойной кислоты):
C6H5-CnH2n+1 +
3n[O] KMnO4,H+→ C6H5-COOH
+ (n-1)CO2 + nH2O
5C6H5-CH3 + 6KMnO4 +
9H2SO4 → 5C6H5-COOH + 3K2SO4 +
6MnSO4 + 14H2O
толуол
бензойная кислота
5. Получение
муравьиной кислоты:
1 стадия: CO + NaOH t,p → HCOONa (формиат натрия – соль)
2 стадия: HCOONa + H2SO4 → HCOOH + NaHSO4
6. Получение уксусной
кислоты:
CH3OH + CO t,p → CH3COOH
Метанол
II. В лаборатории
1. Гидролиз сложных
эфиров:
2. Из солей карбоновых
кислот:
R-COONa + HCl → R-COOH + NaCl
3. Растворением
ангидридов карбоновых кислот в воде:
(R-CO)2O + H2O → 2 R-COOH
4. Щелочной гидролиз
галоген производных карбоновых кислот:
III. Общие способы получения карбоновых
кислот
1. Окисление
альдегидов:
R-COH + [O] → R-COOH
Например, реакция «Серебряного
зеркала» или окисление гидроксидом меди (II) – качественные реакции
альдегидов
2. Окисление спиртов:
R-CH2-OH + 2[O] t,kat →
R-COOH + H2O
3. Гидролиз
галогензамещённых углеводородов, содержащих три атома галогена у одного атома
углерода.
4. Из цианидов
(нитрилов) – способ позволяет наращивать углеродную цепь:
СH3-Br
+ Na-C≡N → CH3-CN + NaBr
CH3-CN - метилцианид ( нитрил уксусной
кислоты)
СH3-CN
+ 2H2O t → CH3COONH4
ацетат аммония
CH3COONH4 + HCl → CH3COOH + NH4Cl
5. Использование реактива Гриньяра
R-MgBr + CO2 → R-COO-MgBr H2O → R-COOH + Mg(OH)Br
ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ
Муравьиная
кислота – в
медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в
пчеловодстве, в органическом синтезе, при получении растворителей и
консервантов; в качестве сильного восстановителя.
Уксусная
кислота – в
пищевой и химической промышленности (производство ацетилцеллюлозы, из которой
получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза
красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как
вкусовое и консервирующее вещество.
Масляная
кислота – для
получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая
кислота – в
металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH
и пальмитиновая кислота C15H31COOH
– в качестве поверхностно-активных веществ, смазочных материалов в
металлообработке.
Олеиновая
кислота C17H33COOH
– флотореагент и собиратель при обогащении руд цветных металлов.
Отдельные представители
одноосновных предельных карбоновых кислот
Муравьиная
кислота впервые
была выделена в XVII веке из красных лесных муравьев. Содержится также в соке
жгучей крапивы. Безводная муравьиная кислота – бесцветная жидкость с острым
запахом и жгучим вкусом, вызывающая ожоги на коже. Применяется в текстильной
промышленности в качестве протравы при крашении тканей, для дубления кож, а
также для различных синтезов.
Уксусная кислота широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях). Образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Температура плавления безводной уксусной кислоты + 16,5°C, кристаллы ее прозрачны как лед, поэтому ее называют ледяной уксусной кислотой. Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем. Натуральный уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную эссенцию, используемую в пищевой промышленности для консервирования овощей, грибов, рыбы. Уксусная кислота широко используется в химической промышленности для различных синтезов.
Представители ароматических и непредельных карбоновых
кислот
Бензойная
кислота C6H5COOH - наиболее
важный представитель ароматических кислот. Распространена в природе в
растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах
она содержится в продуктах распада белковых веществ. Это кристаллическое
вещество, температура плавления 122°C, легко возгоняется. В холодной воде
растворяется плохо. Хорошо растворяется в спирте и эфире.
Ненасыщенные
непредельные кислоты с одной двойной связью в молекуле имеют общую формулу CnH2n-1COOH.
Высокомолекулярные
непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая
распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН
или C17H33COOH. Она
представляет собой бесцветную жидкость, затвердевающую на холоде.
Особенно важны полиненасыщенные кислоты с несколькими двойными связями:линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17H31COOH с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН илиC17H29COOH с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др.Линолевая кислота C17H31COOH и линоленовая кислота C17H29COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой.
Особенно важны полиненасыщенные кислоты с несколькими двойными связями:линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17H31COOH с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН илиC17H29COOH с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др.Линолевая кислота C17H31COOH и линоленовая кислота C17H29COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой.
Сорбиновая (2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН
была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный
консервант, поэтому ягоды рябины не плесневеют.
Простейшая
непредельная кислота, акриловая СН2=СНСООН,
имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой
кислоты) используются для получения органического стекла, а ее нитрил
(акрилонитрил) – для изготовления синтетических волокон.
Называя
вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название
ближайшего гомолога акриловой кислоты, кротоновой
СН3–СН=СН–СООН,
происходит вовсе не от крота, а от растения Croton tiglium, из
масла которого она была выделена. Очень важен синтетический изомер кротоновой
кислоты –метакриловая кислота СН2=С(СН3)–СООН,
из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную
пластмассу – оргстекло.
Непредельные карбоновые кислоты способны к реакциям
присоединения:
СН2=СН-СООН + Н2
→ СН3-СН2-СООН
СН2=СН-СООН + Сl2 → СН2Сl-СНСl-СООН
СН2=СН-СООН + HCl
→ СН2Сl-СН2-СООН
СН2=СН-СООН + Н2O
→ НО-СН2-СН2-СООН
Две последние реакции протекают
против правила Марковникова.
Непредельные карбоновые кислоты и их
производные способны к реакциям полимеризации.
УПРАЖНЕНИЯ
1. Каким образом можно осуществить реакции: ацетат натрия → уксусная
кислота → хлоруксусная кислота? Напишите уравнения реакций.
Решение:
Уксусная кислота — слабая,
поэтому сильные кислоты вытесняют ее из ее солей: CH3COONa +
HCl = СН3СООН + NaCl.
Уксусная кислота на свету реагирует
с хлором:
СН3СООН
+ Сl2 = СН2СlСООН + HCl↑.
________________________________________________________________
2. Как можно получить пропионовую кислоту из бромэтана?
Решение:
СН3СН2Br
→ СН3СН2СООН.
В молекуле пропионовой кислоты
содержится три атома углерода, а в молекуле бромэтана — два. Дополнительный
атом углерода можно ввести в состав молекулы, используя реакцию замещения с
цианидом калия:
CH3CH2Br
+ KCN → CH3CH2CN + КBr.
В этой реакции образуется нитрил
пропионовой кислоты (этилцианид), который гидролизуется при нагревании с
образованием пропионата аммония:
CH3CH2CN +
2Н2О → СН3СН2СООМН4.
Подкисление раствора пропионата
аммония дает пропионовую кислоту:
CH3CH2COONH4 + HCl
→ СН3СН2СООН + NH4Cl.
Другой способ решения этой задачи
связан с использованием магнийорганических соединений и может быть
проиллюстрирован схемой:
Мg
СО2.
Н2О
С2Н5Br → С2Н5МgBr → С2Н5СООМgBr → С2Н5СООН
С2Н5Br → С2Н5МgBr → С2Н5СООМgBr → С2Н5СООН
________________________________________________________________
3. Напишите схему превращений, с помощью которой из 3,3,3-трихлорпропена
можно получить 3-гидроксипропановую кислоту. Укажите условия проведения
реакций.
Решение:
Хлороводород присоединяется к
3,3,3-трихлорпропену против правила Марковникова за счет -/-эффекта группы ССl3:
ССl3-СН=СН2 + HCl →ССl3-СН2-СН2Сl.
Гидролиз образующегося
тетрахлорпроизводного водным раствором КОН дает (после подкисления)
гидроксикислоту:
CCl3CH2CH2Cl +
4KOH → НООС-СН2-СН2ОН + 4KCl + Н2О
________________________________________________________________
4. Уксусную кислоту массой 5,40 г поместили в сосуд объемом 4,50 л и
нагрели до температуры 200 °С. Давление паров при этом составило 43,7 кПа.
Определите число молекул димера уксусной кислоты в газовой фазе.
Решение:
В парах уксусная кислота находится
частично в виде димеров, а частично в виде отдельных молекул:
х
моль х/2 моль
2СН3СООН → (СН3СООН)2
2СН3СООН → (СН3СООН)2
Исходное количество уксусной
кислоты: v(CH3COOH) = m/ M = 5,4 / 60 = 0,09 моль.
Пусть в реакцию димеризации вступило х моль СН3СООН,
тогда образовалось х/2 моль димера (СН3СООН)2 и
осталось (0,09 — х) моль СН3СООН. Общее количество веществ в газовой
фазе равно:
v = PV / (RT) = 43,7
* 4,50 / (8,31 * 473) = 0,05 = х/2 + (0,09 – х),
откуда х = 0,08 моль. Число молекул
димера уксусной кислоты в газовой фазе равно:
N[(СН3СООН)2]
= v * NA = 0,08 / 2 * 6,02*1023 =
2,408*1022.
Ответ. 2,408*1022 молекул
(СН3СООН)2.
________________________________________________________________
5. Напишите уравнения реакций, соответствующие следующей схеме:
Решение:
1) Этанол окисляется до ацетата
натрия хроматом натрия в щелочном растворе:
ЗС2Н5ОН + 4Na2CrO4 + 7NaOH + 4H2O = 3CH3COONa
+ 4Na3[Cr(OH)6].
2) Этилацетат гидролизуется под
действием щелочей:
СН3СООС2Н5 + NaOH = CH3COONa +
С2Н5ОН.
3) Этанол окисляется до
уксусной кислоты дихроматом калия в кислом растворе:
5С2Н5ОН
+ 4KMnO4 + 6H2SO4 = 5СН3СООН
+ 2K2SO4 +4MnSO4 + 11H2O.
4) Этилацетат можно получить из
ацетата натрия действием этилиодида:
CH3COONa
+ C2H5I = СН3СООС2Н5 +
Nal.
5) Уксусная кислота — слабая,
поэтому сильные кислоты вытесняют ее из
ацетатов:
CH3COONa
+ HCl = СН3СООН + NaCl
6) Сложный эфир образуется при
нагревании уксусной кислоты с этанолом в присутствии серной кислоты:
H2SO4
|
||
СН3СООН + С2Н5ОН
|
⇌СН3СООС2Н5 + Н2О
|
________________________________________________________________
6.
________________________________________________________________
7.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Напишите
и назовите по номенклатуре ИЮПАК все изомеры карбоновых кислот с числом атомов
углерода, равным 5 (валериановые кислоты).
2. Как
меняется кислотность (сила) карбоновых кислот в ряду: метановая, этановая,
пропановая, изобутановая? В чем причина изменения кислотных свойств?
3. Как
меняется кислотность замещенной уксусной кислоты в ряду: уксусная,
хлоруксусная, дихлоруксусная, трихлоруксусная? В чем причина изменения
кислотных свойств?
4. Как
меняется кислотность замещенных бутановых кислот в ряду: бутановая,
2-хлорбутановая, 3-хлорбутановая, 4-хлорбутановая? В чем причина изменения
кислотных свойств?
5.
Расположите в ряд по увеличению кислотности следующие соединения:
трихлоруксусная кислота, уксусная кислота, аминоуксусная кислота, хлоруксусная
кислот, пропионовая кислота. Какое влияние на кислотность оказывает
заместитель? Какие электронные эффекты в молекулах оказывают решающее влияние
на изменение кислотных свойств указанных соединений?
6.
Расположите в ряд по увеличению кислотных свойств следующие соединения:
бензойная кислота, п-гидроксибензойная кислота, п-нитробензойная кислота,
2,4,6-тринитробензойная кислота, м-нитробензойная кислота, 2,4-динитробензойная
кислота. Объясните изменение кислотных свойств. Какие электронные эффекты в
молекулах оказывают решающее влияние на изменение кислотных свойств указанных
соединений?
7. Напишите структурные формулы кислот с молекулярной
формулой С5Н10О2 и назовите их по
международной номенклатуре.
8. Напишите
уравнения получения этилацетата из ацетилена, используя его в качестве
единственного органического вещества.
9. На
нейтрализацию предельной органической карбоновой кислоты массой 4,8 г
потребовался раствор объемом 16,95 мл (p = 1,18 г/мл) с массовой долей КОН 22,4 %. Определите формулу кислоты.
10. Назовите
следующие соединения по международной номенклатуре:
|
1.
Укажите название изомера масляной кислоты:
|
|
|
а) валериановая кислота
|
б) пентановая кислота
|
|
в) 2-метилпропановая кислота
|
г) щавелевая кислота
|
|
2.
Укажите формулу самой сильной кислоты:
|
|
|
а) CH(Cl)2-COOH
|
б) CH2(Br)-COOH
|
|
в) CH2(I)-COOH
|
г) CH3-COOH
|
|
3.
Укажите число изомерных карбоновых кислот состава
С5Н10О2:
|
|
|
а) 3
|
б) 2
|
|
в) 4
|
г) 5
|
|
4.
При растворении в воде 1 моль уксусного ангидрида
образуется:
|
|
|
а) 2 моль этаналя
|
б) 2 моль этанола
|
|
в) 2 моль уксусной кислоты
|
г) 1 моль метилацетата
|
|
5.
При взаимодействии этанола и оксида углерода (II) в соответствующих условиях получается:
|
|
|
а) этаналь
|
б) пропаналь
|
|
в) пропановая кислота
|
г) метилацетат
|
|
6.
С помощью какого одного реактива можно различить
растворы глицерина, пропаналя и этановой кислоты:
|
|
|
а) бромная вода
|
б) карбонат калия
|
|
в) гидроксид меди (II)
|
г) азотная кислота
|
|
7.
В реакциях с какими веществами с участием уксусной
кислоты от ее молекулы отщепляется гидроксильная группа:
|
|
|
а) металлами
|
б) щелочами
|
|
в) спиртами
|
г) карбонатами металлов
|
|
8.
Растворы с уксусной и муравьиной кислотой можно
различить с помощью:
|
|
|
а) лакмуса
|
б) карбоната натрия
|
|
в) гидроксида меди (II)
|
г) железных стружек
|
|
9.
Какая кислота получается при окислении
изобутилового спирта:
|
|
|
а) бутановая
|
б) масляная
|
|
в) валериановая
|
г) 2-метилпропановая
|
|
10.
Гомологи
уксусной кислоты являются электролитами:
|
|
|
а) слабыми
|
б) сильными
|
|
в) амфотерными
|
г) все предыдущие ответы неверны
|
Ответы:
|
1
|
в
|
|
2
|
а
|
|
3
|
в
|
|
4
|
в
|
|
5
|
в
|
|
6
|
в
|
|
7
|
в
|
|
8
|
в
|
|
9
|
г
|
|
10
|
а
|


























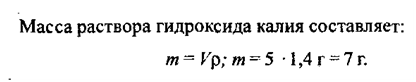



Комментариев нет:
Отправить комментарий