5.2. Количественная характеристика состава
растворов
Для
качественной характеристики растворов используют понятия «разбавленный раствор» (содержит мало растворенного вещества) и «концентрированный раствор» (содержит
много растворенного вещества).
При
работе с растворами необходимо знать их количественный состав. Количественный
состав растворов выражается различными способами. Мы изучим два способа: а)
массовая доля растворенного вещества;
б) молярная концентрация (молярность).
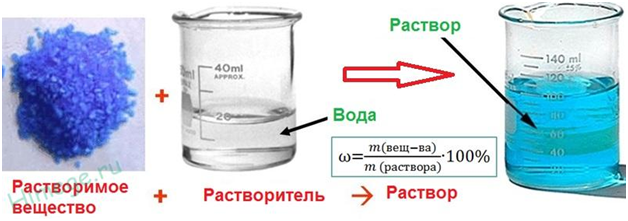
Массовая доля растворенного вещества
Массовая
доля растворённого вещества -это отношение массы растворённого вещества к массе
раствора.
Для
расчёта процентной концентрации используется формула:
Массовая доля растворённого вещества wрастворённого
вещества - это безразмерная
величина, равная отношению массы растворённого вещества mрастворённого
вещества к общей
массе раствора mраствора :
mраствора = mрастворённого вещества + mрастворителя
Массовую долю растворённого вещества (процентная
концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля
растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это
означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция
массой 6 г и вода массой 94 г.
ЗАПОМНИТЕ!
Молярная
концентрация
Молярная концентрация С – это
отношение количества растворенного вещества v (в молях) к объему раствора V в
литрах.
Единица молярной
концентрации – моль/л. Зная число молей вещества в 1 л раствора, легко отмерить
нужное количество молей для реакции с помощью подходящей мерной посуды.
В качестве примера
рассмотрим получение нерастворимого в воде хлорида серебра (AgCl) с помощью
реакции обмена:
AgNO3 + NaCl = AgCl (осадок) + NaNO3
Допустим, в лаборатории имеется раствор AgNO3, концентрация
которого 1 моль/л. Это означает, что в 1 л такого раствора содержится 1 моль
нитрата серебра.
По уравнению реакции на 1 моль AgNO3 нужен 1 моль NaCl.
Следовательно, если мы смешаем одинаковые объемы растворов AgNO3 и
NaCl одинаковой концентрации 1 моль/л, то реакция пройдет до конца и в
реакционной колбе окажется только раствор нитрата натрия (NaNO3) в
воде, а на дно сосуда выпадет осадок хлорида серебра AgCl. При этом исходных
соединений в сосуде не останется.
** Молярную концентрацию (или МОЛЯРНОСТЬ растворов)
принято обозначать буквой М. Например, раствор концентрации 1 М содержит 1 моль
вещества на литр раствора. Такой раствор называют
МОЛЯРНЫМ. Раствор концентрации 0,1 М содержит 0,1 моль вещества на
литр раствора и называется ДЕЦИМОЛЯРНЫМ.
Растворы концентрации 0,01 М (или 0,01 моль на литр) иногда называют САНТИМОЛЯРНЫМИ.
УПРАЖНЕНИЯ
1. Сколько
грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
1. Запишем формулу для расчёта массовой
доли:
2. Преобразуем формулу и вычислим массу
растворённого вещества в растворе
m растворённого вещества = (wрастворённого вещества · mраствора) / 100%
m растворённого
вещества = (5 % · 300 г) / 100% = 15 г
3. Вычислим массу растворителя – воды:
m раствора = m растворённого вещества + m (H2O)
m (H2O) = m раствора - m растворённого вещества = 300 г - 15 г =
285 г
Ответ: Для приготовления 300 г 5%
раствора надо взять 15 г соли и 285 г воды.
__________________________________________________________________
2. Сахар массой
12,5г растворили в 112,5г воды.
Определите
массовую долю сахара в полученном растворе.
Решение:
1. Запишем формулу для расчёта массовой
доли:
2. Вычислим массу раствора:
m раствора = m растворённого вещества + m (H2O)
m раствора = 12,5 г + 112,5
г = 125 г
2. Вычислим массовую долю сахара:
w% = (12,5 г ·
100%) / 125 г = 10 % или 0,1
Ответ: w% = 10 %
__________________________________________________________________
3. Смешали два
раствора соли: 120г 5%-ного раствора и 130г 15%-ного раствора. Вычислите
массовую долю соли в образовавшемся растворе.
Решение:
1. Запишем формулу для
расчёта массовой доли:
2. Преобразуем формулу
и вычислим массы растворённого вещества в растворах 1 и 2
4. m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества 1 = (5 % · 120 г) / 100%
= 6 г
m растворённого вещества 2 = (15 % · 130 г) /
100% = 19,5 г
2. Общая масса
растворённого вещества в полученном растворе:
m растворённого вещества 3 = m растворённого вещества 1+ mрастворённого вещества 2 =6 г + 19, 5 г = 25,5
г
3. Вычислим массу
раствора, полученного при сливании двух растворов:
m раствора 3 = m раствора 1 + m раствора 2 = 120 г + 130 г = 250 г
4. Вычислим массовую
долю вещества в полученном растворе:
Wр.в. 3= (m р.в. 3 · 100%) /m раствора 3 = (25,5 г ·
100%) /250 г = 10,2 %
Ответ: Wр.в. 3 = 10,2 %
__________________________________________________________________
4.
__________________________________________________________________
5.
_____________________________________________________________
6.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Вычислите массовую долю растворённого вещества,
если в 88г воды растворили 12г соли.
|
2. Рассчитайте массы соли и воды, необходимые для
приготовления 400г раствора с массовой долей соли 0,05.
|
3. Как изменится процентная концентрация раствора,
если к 10%-раствору соли массой 100г добавить 20г воды.
|
4. Как изменится процентная концентрация раствора,
если к 10%-раствору соли массой 100г добавить 20г соли.
|
5. Вычислите молярную концентрацию
раствора поваренной соли, если в 500 мл этого раствора содержится 0,5 моль
хлорида натрия.
|
6. Вычислите молярную массу вещества, если известно,
что в 24л раствора с молярной концентрацией 6 моль/л было растворено 2880 г
вещества.
|
7. Поваренную
соль массой 5 г растворили в 45 г воды. Определите массовую долю (%) соли в
растворе.
|
1.
Какие растворы могут находится в контакте с
кристаллами растворенного вещества:
|
|
|
а) насыщенные
|
б) разбавленные
|
|
в) все ответы верны
|
г) концентрированные
|
|
2.
Растворимость веществ зависит от:
|
|
|
а) их природы
|
б) природы растворителя
|
|
в) все ответы верны
|
г) температуры
|
|
3.
Какие характеристики применимы для описания
истинных растворов:
|
|
|
а) однородные системы
|
б) системы постоянного состава
|
|
в) нет верного ответа
|
г) неоднородные системы
|
|
4.
Растворение хлорида аммония в воде можно отразить
схемой NH4Cl(к) + Н2О
↔ NH4Cl(ж) –Q.
Растворимость этой соли в воде можно повысить:
|
|
|
а) повышая температуру
|
б) увеличивая степень измельчения соли
|
|
в) увеличения объема воды
|
г) интенсивным перемешиванием раствора
|
|
5.
Интенсивный раствор получается при смешивании
между собой по 50 г:
|
|
|
а) воды и этанола
|
б) воды и бензола
|
|
в) воды и бензина
|
г) воды и карбоната кальция
|
|
6.
Какие явления
происходят при растворении кристаллического хлорида натрия в воде:
|
|
|
а) хаотическое движение
гидратированных ионов Na+ и Cl-
|
б) разрушение кристаллической решетки
соли
|
|
в) все ответы верны
|
г) направленное движение
гидратированных ионов соли
|
|
7.
Какие утверждения не справедливы для ненасыщенного раствора некоторого
вещества:
|
|
|
а) может быть разбавленным
|
б) может быть концентрированным
|
|
в) не может быть концентрированным
|
г) в таком растворе можно растворить
дополнительную порцию этого же вещества
|
|
8.
Какие явления отвечают за величину и знак
теплового эффекта растворения кристаллических веществ в воде:
|
|
|
а) гидрирование
|
б) разрушение кристаллической решетки
вещества
|
|
в) диффузия частиц растворенного
вещества в воде
|
г) все ответы верны
|
|
9.
При растворении в воде массой 36 г медного
купороса массой 5 г получается раствор с массовой доле CuSO4 (%):
|
|
|
а) 8,7
|
б) 9,8
|
|
в) 7,8
|
г) 6,8
|
|
10.
В 100 мл
воды растворили 2 г CaCl2. Какова масса (г) ионов Са2+
в 20 мл такого раствора (изменением объема при растворении можно пренебречь):
|
|
|
а) 0,400
|
б) 0,444
|
|
в) 0,144
|
г) 0,288
|
Ответы:
|
1
|
в
|
|
2
|
в
|
|
3
|
а
|
|
4
|
а
|
|
5
|
а
|
|
6
|
в
|
|
7
|
в
|
|
8
|
б
|
|
9
|
в
|
|
10
|
в
|













Комментариев нет:
Отправить комментарий