11.3.
Понятие о гетероциклических соединениях
Гетероциклические
соединения — это
органические соединения, содержащие в своих молекулах кольца (циклы), в
образовании которых кроме атома углерода принимают участие и атомы других
элементов.
Строение и номенклатура
Ароматические гетероциклы представляют собой плоские циклические системы,
содержащие вместо одного или нескольких атомов углерода атомы кислорода, серы,
азота. Ароматическими их называют вследствие того, что они удовлетворяют всем
критериям, присущим любой ароматической системе, а именно:
• система является циклической;
• цикл является плоским;
• имеется сопряжение по всему циклу, то есть возможность беспрепятственной
делокализации любого из p-электронов по всей системе, благодаря наличию
негибридизованных р-орбиталей;
• число делокализованных p-электронов, участвующих в сопряжении, отвечает,
согласно правилу Хюккеля, проявлению ароматических свойств, а именно, равно
4n+2, где n – любое натуральное число, включая 0.
Среди ароматических гетероциклических соединений наиболее широко распространены
и, соответственно, представляют наибольший интерес 5- и 6-членные гетероциклы,
имеющие в своем составе азот, серу и кислород, а также эти же системы,
конденсированные с бензольным кольцом.
К пятичленным циклическим системам с одним гетероатомом относятся пиррол,
фуран и тиофен:
Из пятичленных гетероциклов с двумя гетероатомами наибольший практический
интерес представляет имидазол.
К конденсированным с бензольным кольцом пятичленным гетероциклам относятся
2,3-бензопиррол (индол, I), 3,4-бензопиррол (изоиндол, II), бензимидазол (III),
бензофуран (IV) и 2,3-бензотиофен (V):
Наиболее важными из шестичленных гетероциклов являются пиридин, пиримидин,
хинолин (бензопиридин) и пурин:
Характерной особенностью пятичленных гетероциклических соединений является
одновременное сочетание у них свойств как ароматического соединения, так и
диена. Склонность к реакциям того и другого типов, однако, у них различна и
связана с природой гетероатома. Так, «ароматические» свойства убывают в ряду: тиофен > пиррол > фуран. При этом
их ароматические системы менее устойчивы, чем у бензола.
Гетероциклические соединения чрезвычайно широко распространены в живой
природе. Так, гетероциклы семейств пурина и пиримидина являются неотъемлемой
частью нуклеиновых кислот, ответственных за хранение и передачу наследственной
информации. Взаимодействие пуриновых и пиримидиновых производных по системе
водородных связей лежит в основе процессов репликации, транскрипции и трансляции,
основ функционирования любой живой клетки.
В технике и в промышленности гетероциклические соединения находят
применение в качестве растворителей (тетрагидрофуран, пиридин), компонентов
красителей, являются важными компонентами очень многих синтетических
лекарственных средств, исходными соединениями при синтезах целого ряда важных
химических соединений.
Химические свойства
Пятичленные ароматические
гетероциклы и их производные
Как уже было отмечено,
устойчивость ароматической системы убывает в ряду: Тиофен > Пиррол
> Фуран.
Наименее ароматичный фуран, присоединяя в кислой среде протон по атому
кислорода, образует диеновую систему, склонную к полимеризции и осмолению.
Поэтому реакции электрофильного замещения в фуране (проходящие настолько же легко,
как и в фенолах) проводят в нейтральных и щелочных средах. Так, фуран
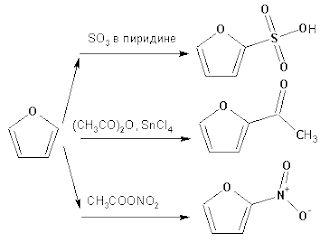
ацилируется ангидридами кислот в присутствии SnCl4, сульфируется
пиридинсульфотриоксидом (мягкий сульфирующий агент), нитруется ацетилнитратом:
Галогенирование фурана галогенами приводит к замещению всех четырех атомов
водорода:
Моногалоидные производные получают косвенным путем:
Фуран легко вступает в реакцию Дильса–Альдера с диенофилами (малеиновый
ангидрид):
При нагревании с разбавленной соляной кислотой цикл легко раскрывается:
Фурановый цикл приобретает устойчивость при наличии в нем
электроноакцепторных заместителей: -NO2, -CHO, -COOH, -SO2OH,
галогены.
Из производных фурана большое значение имеет применяемый в качестве
растворителя тетрагидрофуран, получаемый при гидрировании фурана на никелевом
катализаторе.
Методы получения
Фуран получают в промышленных масштабах из
фурфурола, каталитическим декарбонилированием:
Сам фурфурол получают кипячением с разбавленными кислотами пятиатомных углеводов
(пентоз), которые в больших количествах содержатся в подсолнечной шелухе,
кукурузных початках, отрубях и др.
Тиофен получают циклизацией бутана или бутилена
в парах серы при 700 °С:
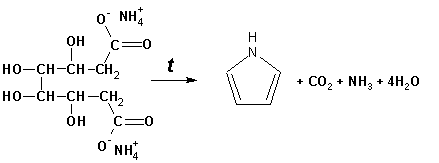
Пиррол (в переводе означает «красное масло»)
получают пиролизом аммонийной соли слизевой кислоты:
или восстановлением сукцинимида цинковой пылью:
Ю.К. Юрьев открыл реакции взаимопревращений пятичленных гетероциклов,
которые также применяют с целью их получения. Реакция идет в токе сероводорода,
аммиака и воды, при высоких температурах, над окисью алюминия:
Шестичленные ароматические гетероциклы и их
производные
Распределение электронной плотности по атомам пиридинового кольца показано
на схеме:
Молекула пиридина поляризована, и отрицательный центр поляризации
сосредоточен на атоме азота. Вследствие этого, как уже было отмечено ранее,
электрофильное замещение в пиридине протекает значительно труднее, чем в
незамещенном бензоле, а нуклеофильное – легче, особенно при взаимодействии с
сильными основаниями:
Так, сульфирование пиридина пиросерной кислотой протекает при 250 °С в
бета-положении, нитрование нитратом калия в азотной кислоте также проходит с
трудом, только при 350 °С и с выходом 15 %, в то время как реакция с
амидом натрия идет при сравнительно небольшом нагревании.
Атом азота в пиридине устойчив по отношению к окислителям, поэтому
алкилпиридины легко окисляются до пиридинкарбоновых кислот:
Однако, под действием перекисей, пиридин легко превращается в окись
пиридина:
Последняя легко подвергается реакциям электрофильного замещения, с
образованием замещенных, подобно активированным электронодонорными
заместителями производным бензола:
На схеме отчетливо видно, каким образом в окиси пиридина кольцо
активировано к электрофильному замещению, притом, во 2-м и 4-м положениях.
Это важный способ получения производных пиридина, которые не могут быть
получены путем прямого замещения. После реакции замещения окись восстанавливают
в пиридин диметилсульфоксидом.
УПРАЖНЕНИЯ
1.
Составьте структурные формулы важнейших азотсодержащих
гетероциклических соединений, в том числе с конденсированными кольцами.
Решение:
________________________________________________________________
2.
Поясните, какие соединения
относятся к гетероциклическим. Приведите примеры и напишите их формулы и
названия.
|
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какие
соединения называют гетероциклическими.
2. По
каким признакам подразделяют гетероциклические соединения.
3.
Атомы каких элементов наиболее часто входят в состав нетероциклов.
4. Какие
из нижеперечисленных соединений можно отнести к пятичленным гетероциклическим
соединениям: бензол, нафталин, хинолин, пурин, пиримидин, фуран, пиридин,
тиофен, катион пирилия, пиррол.
5. Какие
из нижеперечисленных соединений можно отнести к шестичленным гетероциклическим
соединениям: бензол, нафталин, хинолин, пурин, пиримидин, фуран, пиридин,
тиофен, катион пирилия, пиррол.
6.
Почему пятичленные гетероциклы обладают ароматическим характером.
7.
Почему пиррол является амфотерным соединением.
8.
Почему пиридин обладает более выраженными основными свойствами в сравнении с
пирролом.
9.
Назовите пятичленный гетероцикл с двумя гетероатомами.
10.
Какие биологически важные природные соединения являются производными имидазола.
|
1.
ЗАДАНИЕ. Среди предложенных утверждений выберите истинные:
|
|
|
1) Пиридин –
шестичленный азотсодержащий гетероцикл
|
2) Пиридин кипит
при 130 °С
|
|
3) Пиррол – газ
с резким запахом, ограниченно растворимый в воде
|
4) Пиррол
обладает слабовыраженными ароматическими свойствами и очень слабыми основными
свойствами
|
|
5) Основные
свойства пиридина подтверждает его способность вступать в реакцию нитрования
|
6) Неподеленная
пара электронов атома азота в молекуле пиррола участвует в образовании единой
6
|
|
7) Источником
промышленного получения пиридина служит каменноугольная смола
|
8) Пиридиновые
структуры присутствуют в молекулах хлорофилла, гемоглобина, биллирубина
|
|
9) Производные
пиридина – алкалоиды – широко распространены в растительном и животном мире
|
10) В молекуле
гемоглобина пиррольные структуры связаны с атомом меди
|
|
11) Производные
пиррола используются для защиты металлов от коррозии
|
12) Производные
азотсодержащего гетероциклического соединения пиримидина – пиримидиновые
основания: тимин, цитозин и урацил – входят в состав макромолекул нуклеиновых
кислот
|
|
2.
ЗАДАНИЕ. Среди предложенных утверждений выберите истинные:
|
|
|
1) Пиррол –
шестичленный азотсодержащий гетероцикл
|
2) Пиррол кипит
при 130 °С
|
|
3) Пиридин –
бесцветная жидкость с запахом, напоминающим запах хлороформа, ограниченно
растворимая в воде
|
4) Пиридин
обладает ароматическими свойствами, более ярко выраженными по сравнению с
пирролом, но относительно слабыми по сравнению с бензолом
|
|
5) Пиррол
способен реагировать с калием, в результате чего выделяется водород
|
6) Неподеленная
пара электронов атома азота в молекуле пиридина участвует в образовании
единой 6
|
|
7) Источником
промышленного получения пиррола служит каменноугольная смола
|
8) Пиридин
активно используется для денатурации этилового спирта
|
|
9) Пиррол
применяется для синтеза лекарственных средств
|
10) В молекуле
хлорофилла пиррольные структуры связаны с атомом кальция
|
|
11) Производным
пиридина является алкалоид никотин, который при малых дозах вызывает
возбуждение центральной нервной системы, а уже при небольшой передозировке
действует на живой организм как сильный яд
|
12) Производные азотсодержащего
гетероциклического соединения пурина – пуриновые основания: аденин и гуанин –
входят в состав макромолекул белков
|
Ответы:
|
1
|
1, 4, 6, 7, 9, 12
|
|
2
|
2, 4, 5, 8, 9, 11
|


















Комментариев нет:
Отправить комментарий