8.7.
Оксиды азота. Азотная кислота
Оксиды азота
В отличие от других элементов азот
образует большое число оксидов: N2O, NO, N2O3,
NO2, N2O4, N2O5. Все оксиды азота
термодинамически неустойчивы к распаду на простые вещества, однако при
700 °С реакция разложения оксидов кинетически заторможена. Рассмотрим
свойства оксидов.
Оксид азота (I) N2O
Строение молекулы
Молекула N2O линейная,
малополярная, её строение описывается при помощи двух резонансных структур.
Связь между атомами азота равна 0,113 нм, она сравнима с длиной тройной
связи.
Физические свойства
При комнатной температуре оксид азота (I)
N2O – бесцветный газ, без запаха, сладковатый на вкус, растворим в
воде, при 0 °С 1 объем газа растворяется в 1 объеме воды. Температура
плавления -91 °С, температура кипения -89 °С. При вдыхании вызывает
судорожный смех, поэтому имеет название «веселящий газ».
Химические свойства
Оксид азота (I) не взаимодействует с
водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в
кислороде, вспыхивает тлеющая лучина и ярко горит сера.
При нагревании выше 600 °С
разлагается со взрывом:
2N2O = 2N2 + O2.
Взаимодействует с водородом:
N2O + H2 = N2 + H2O.
При поджигании смеси оксида азота (I) и
аммиака происходит взрыв:
3N2O + 2NH3 = 4N2 + 3H2O.
При взаимодействии с сильными окислителями
проявляет восстановительные свойства:
5N2O +
2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O.
Получение
Оксид азота (I) получают термическим
разложением нитрата аммония при температуре около 200 °С:
NH4NO3 = N2O + 2H2O,
нагревание нужно проводить очень осторожно, перегрев и
использование больших количеств нитрата может привести к взрыву.
Оксид азота (II) NO
Строение молекулы
Молекула NO малополярная, линейная, длина
связи составляет 0,115 нм, её строение описывается двумя резонансными
структурами, обе формы имеют один неспаренный электрон, поэтому молекула
является радикалом, но при обычных условиях не склонна к димеризации.
Физические свойства
При комнатной температуре оксид азота (II)
NO – бесцветный газ, без вкуса и запаха. Растворим в воде, при 0 °С
5 мл газа растворяется в 100 мл воды. Температура плавления
-164,4 °С, температура кипения -152,2 °С.
Химические свойства
Оксид азота (II) не взаимодействует с
водой. Несолеобразующий оксид. Проявляет восстановительные свойства.
Он легко окисляется кислородом:
2NO + O2 = 2NO2.
Взаимодействует с перманганатом калия в
кислой среде:
5NO + 3KMnO4 + 2H2SO4 = 2MnSO4 + 3KNO3 + Mn(NO3)2 + 2H2O.
С хорошими восстановителями проявляет
окислительные свойства, и восстанавливается до азота:
Реагирует с сернистым газом:
2NO + 2SO2 = 2SO3 + N2.
При использовании родиевого катализатора
окисляет угарный газ в углекислый:
2NO + 2CO = 2CO2 + N2,
такие катализаторы устанавливаются в
выхлопных трубах автомобилей.
Не реагирует с кислотами, при
взаимодействии с расплавленной щелочью диспропорционирует:
6NO + 4KOH = N2 + 4KNO2 + 2H2O.
Получение
В лаборатории получают действием на медь разбавленной азотной кислоты:
3Cu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O.
В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе
при 700 °С:
4NH3 + 5O2 = 4NO + 6H2O.
В атмосфере образуется из простых веществ в грозовых разрядах:
N2 + O2 = 2NO.
Оксид азота (III) N2O3
Строение молекулы
Молекула N2O3 плоская и состоит из фрагментов ON – NO2 c непрочной связью N – N. У атома азота имеется неподеленная пара
электронов. Твердый оксид азота (III) – ионное соединение.
Физические свойства
Оксид азота (III) N2O3 – крайне неустойчивое соединение и существует только при низких
температурах, выше 0 °С оно разлагается. Температура плавления
-100 °С, температура кипения -40 °С. В твердом и жидком состоянии
окрашен в синий цвет.
Химические свойства
Оксид азота (III) – типичный кислотный
оксид, взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O = 2HNO2.
При взаимодействии со щелочами образуются
соли азотной кислоты – нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O.
Получение
1.
Образуется при охлаждении до -36 °С смеси оксидов азота (II) и (IV):
NO + NO2 = N2O3.
2.
При взаимодействии 50 %-ной азотной кислоты с оксидом мышьяка (III)
при низкой температуре:
2HNO3 + As2O3 + 2H2O
= 2H2AsO4 + N2O3.
3.
При обезвоживании азотистой кислоты:
NaNO2 + H2SO4 = NaHSO4 + HNO2;
2HNO2 = N2O3 + H2O.
Оксид азота (IV) NO2 и N2O4
Строение молекулы
Оксид азота (IV) в широком интервале
температур существует в виде равновесной смеси мономера NO2 и димера N2O4.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии
sp2-гибридизации, длина связи N – O равна 0,119 нм, что
соответствует полуторной связи.
NO2
На атоме азота имеется неспаренный
электрон, поэтому он легко димеризуется с образованием димера N2O4.
Молекула N2O4 плоская и состоит из
фрагментов2ON – NO2 c непрочной связью N –
N.
N2O4
Физические свойства
Оксид азота (IV) NO2 – бурый газ, с резким удушливым запахом, ядовит, N2O4 – бесцветен. Твердый оксид азота (IV) бесцветен и состоит только из молекул
N2O4. При его нагревании до температуры плавления
-12,8 °С появляется бурая окраска, которая усиливается при повышении
температуры и увеличения доли мономера в смеси. Температура кипения
21,5 °С.
Химические свойства
Оксид азота, и мономер, и димер, хорошо
растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование
на азотную и азотистую кислоты.
При температуре выше 0 °С реакция
протекает по другому:
3NO2 + H2O = 2HNO3 + NO.
Если через воду пропускать смесь оксида
азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его
атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
Получение
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной
кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных
нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.
Оксид азота (V) N2O5
Строение молекулы
Оксид азота (V) – ангидрид азотной
кислоты, построен из ионов NO2+ и NO3-, в газовой фазе и растворе состоит из молекул
N2O5.
Физические свойства
Азотный ангидрид – бесцветные
гигроскопичные кристаллы, температура сублимации 32,3 °С. Неустойчив и в
течение нескольких часов распадается, при нагревании – со взрывом.
Химические свойства
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную
кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2O5 + I2 = I2O5 + N2.
Получение
1.
Образуется при пропускании азотной кислоты через колонку с оксидом фосфора
(V):
2HNO3 + P2O5 = N2O5 + 2HPO3,
реакция протекает при -10 °С.
2.
Получается при окислении оксида азота (IV) озоном:
2NO2 + O3 = N2O5 + O2.
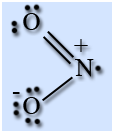
HNO3 - Азотная кислота
Опытным
путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и
атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень
окисления азота +5, а валентность равна IV.
Физические свойства
Азотная
кислота HNO3 в чистом виде - бесцветная жидкость
с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C;
t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она
образуется при грозовых разрядах и присутствует в дождевой воде.
Под
действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого
приобретает светло-бурый цвет:
N2 + O2 грозовые эл.разряды→ 2NO
2NO + O2 → 2NO2
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная
кислота высокой концентрации выделяет на воздухе газы, которые в закрытой
бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень
ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет
многие органические вещества. Бумага и ткани разрушаются вследствие окисления
образующих эти материалы веществ. Концентрированная азотная кислота вызывает
сильные ожоги при длительном контакте и пожелтение кожи на несколько дней
при кратком контакте. Пожелтение кожи свидетельствует о
разрушении белка и выделении серы (качественная реакция на концентрированную
азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при
действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог
кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной
кислотой в резиновых перчатках.
Получение
1. Лабораторный
способ
KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
2. Промышленный способ
a)
Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 → 4NO + 6H2O
(Условия: катализатор – Pt, t = 500˚С)
б) Окисление кислородом
воздуха NO до NO2
2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка
кислорода
4NO2 + О2 + 2H2O ↔ 4HNO3
или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода)
Применение
- в производстве минеральных
удобрений;
- в военной промышленности;
- в фотографии — подкисление
некоторых тонирующих растворов;
- в станковой графике — для
травления печатных форм (офортных досок, цинкографических типографских
форм и магниевых клише).
- в производстве взрывчатых и
отравляющих веществ
Химические свойства
азотной кислоты
Для азотной
кислоты характерны свойства: общие с другими кислотами и специфические:
ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ
С ДРУГИМИ КИСЛОТАМИ
Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
2. Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
3. Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
H+ + OH- → H2O
4. Реагирует с солями, вытесняет слабые кислоты из их
солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→N-3 окислитель, восстанавливается.
1. Разлагается на свету
и при нагревании
4HNO3 t˚C→ 2H2O
+ 4NO2 + O2
Образуется бурый газ
2. Окрашивает белки в оранжево-желтый
цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. Реагирует с
металлами.
В зависимости от концентрации кислоты и положения
металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться
разные азотсодержащие продукты.
При взаимодействии с металлами никогда не выделяется водород
HNO3 + Me = соль + H2O + Х
Щелочные и
щелочноземельные
|
Металлы до
водорода
|
Металлы
после водорода
(Cu и др)
|
Благородные
Au, Pt, Os, Ir,Ta
|
||
HNO3(конц.ω>60%)
|
N2O
|
пассивация
(при обычных условиях);
NO2 (при нагревании)
|
NO2
|
NO2
|
Нет
реакции
|
HNO3(разбавл.)
|
NH3, NH4NO3
|
Основной NO, но в зависимости от разбавления могут
образовываться N2, N2O, NH3,NH4NO3. Чем
больше разбавлена кислота, тем ниже степень окисления азота.
|
NO
|
||
Таблица. Продукты реакции
взаимодействия азотной кислоты с металлами
Упрощенная схема «Продукты реакции взаимодействия азотной
кислоты с металлами»
Царская водка: V(HNO3) : V(HCl) = 1 : 3 растворяет
благородные металлы.
HNO3 + 4HCl + Au = H[AuCl4] + NO + 2H2O
4HNO3 + 18HCl + 3Pt = 3H2[PtCl6] + 4NO + 8H2O
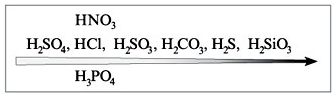
4. Реагирует с неметаллами.
Азотная кислота превращается в NO (или в NO2);
неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 → H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4
HNO3 (конц.) + неметалл =
окисление неметалла до кислоты в высшей степени окисления + NO2 + вода
HNO3 (разбав.) + неметалл + вода = окисление неметалла до
кислоты в высшей степени окисления + NO
Нитраты (селитры)
Азотная
кислота – одноосновная, образует один ряд солей – нитраты состава:
Me(NO3)n
и
NH4NO3
Нитраты калия, натрия, кальция и аммония называют селитрами. Например, селитры:KNO3 – нитрат калия (индийская селитра),
NаNО3 – нитрат
натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра),
NH4NO3 – нитрат
аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет).
Германская промышленность считается первой в мире, получившей соль NH4NO3 из азота N2 воздуха и водорода воды, пригодную для
питания растений.
Физические свойства
Нитраты –
вещества с преимущественно ионным типом кристаллических решёток. При обычных
условиях это твёрдые кристаллические вещества, все нитраты хорошо растворимы в
воде, сильные электролиты.
Получение нитратов
Нитраты образуются при взаимодействии:
1) Металл + Азотная кислота
Cu + 4HNO3(k) = Cu(NO3)2 + 2NO2↑ + 2H2O
2) Основный оксид + Азотная кислота
CuO + 2HNO3 = Cu(NO3)2 + H2O
3) Основание + Азотная кислота
HNO3 + NaOH = NaNO3 +
H2O
4) Аммиак + Азотная кислота
NH3 + HNO3 = NH4NO3
5) Соль слабой кислоты + Азотная кислота
В cоответствии с рядом кислот каждая
предыдущая кислота может вытеснить из соли последующую:
2HNO3 + Na2CO3 =
2NaNO3 + H2O + CO2 ↑
6) Оксид азота (IV) + щёлочь
2NO2 + NaOH =
NaNO2 + NaNO3 + H2O
в присутствии кислорода -
4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
Химические свойства нитратов
I. Общие с другими солями
1) C металлами
Металл, стоящий в ряду активности левее, вытесняет
последующие из их солей:
Cu(NO3)2 +
Zn = Cu + Zn(NO3)2
2) С кислотами
AgNO3 + HCl =
AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 +
2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 =
Ba(NO3)2 + 2AgCl↓
II. Специфические
Все нитраты термически неустойчивы. При
нагревании они разлагаются с образованием кислорода.
Характер других продуктов реакции зависит от положения металла, образующего нитрат,
в электрохимическом ряду напряжений:
1) Нитраты щелочных
(исключение - нитрат лития) и щелочноземельных металлов разлагаются до нитритов:
2NaNO3 =
2NaNO2 + O2↑
2) Нитраты менее активных
металлов от Mg до Cu включительно и нитрат литияразлагаются до оксидов:
2Mg(NO3)2
= 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2
=2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных
металлов (правее меди) разлагаются до металлов:
Hg(NO3)2
= Hg + 2NO2↑ + O2↑
2AgNO3
= 2Ag + 2NO2 ↑+ O2↑
4) Нитрат и нитрит аммония:
Нитрат аммония разлагается в зависимости от
температуры так:
NH4NO3 =
N2O ↑+ 2H2O
(190-245°C)
2NH4NO3 =
N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 =
2N2 ↑+ O2 +
4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O
Исключения:
4LiNO3 =
2Li2O + 4NO2 + O2
Mn(NO3)2=MnO2 + 2NO2
4Fe(NO3)2=2Fe2O3 + 8NO2 +
O2
Качественная реакция на
нитрат-ион NO3– – взаимодействие нитратов c
металлической медью при нагревании в присутствии концентрированной серной
кислоты или с раствором дифениламина в Н2SO4 (конц.).
Протекают следующие уравнения
реакций:
КNO3 (кр.) + Н2SO4 (конц.)
= КНSО4 + НNО3↑
,
Применение нитратов
Почему азота в природе много (он входит в состав атмосферы), а растения
часто дают плохой урожай из-за азотного голодания?
Растения не могут усваивать молекулярный азот N2 из воздуха. Это проблема «связанного азота». При недостатке азота
задерживается образование хлорофилла, поэтому растения имеют бледно-зеленую
окраску, как следствие, задерживается рост и развитие растения. Азот – жизненно
важный элемент. Без белка нет жизни, а без азота нет белка.
Как же усваивается атмосферный азот? Часть связанного азота
поступает в почву во время гроз. Химия процесса такова:
Существуют растения способные повышать плодородие почвы, в
чем же их особенность? Эти растения (люпин, люцерна, клевер, горох,
вика) относятся к семейству бобовых (мотыльковые), на корнях которых
развиваются клубеньковые бактерии, способные связывать атмосферный азот,
переводя его в соединения, доступные для растений.
Растения, связывающие
атмосферный азот
Снимая урожаи, человек ежегодно уносит вместе с ними огромные
количества связанного азота. Эту убыль он покрывает внесением не только
органических, но и минеральных удобрений (нитратных, аммиачных, аммонийных).
Азотные удобрения вносят под все культуры. Азот усваивается растениями в виде
катиона аммония NH4+ и
нитрат-аниона NO3–.
«Классификация азотных удобрений»
Одной из важных характеристик является содержание питательного элемента
в удобрении. Расчет питательного элемента для азотных удобрений ведут по
содержанию азота.
УПРАЖНЕНИЯ
1. Какова массовая доля азота в жидком аммиаке и аммиачной селитре?
Решение:
Формула аммиака –
NH3.
Массовая доля
азота в аммиаке:
W (N) = Ar(N)/Mr(NH3)•100%,
W (N) = 14/17•100% = 82%.
Формула аммиачной
селитры – NH4NO3.
Массовая доля
азота в аммиачной селитре:
W(N) = 2Ar(N)/Mr(NH4NO3)•100%,
W(N) =
2•14/80•100% = 35%.
________________________________________________________________
2. В реакции с
азотной кислотой прореагировало 0,1 моль оксида меди (II). Найдите массу и
количество нитрата меди (II), получившегося в результате реакции.
Решение:
Ответ:
________________________________________________________________
3. Закончить
уравнения реакций, составив для них полные и сокращенные ионные уравнения:
а) CaО + HNO3 →
б) CaCO3 + HNO3 →
в)
Cu(OH)2 +
HNO3
г)
ZnO + HNO3
д) NaOH + HNO3 →
е) Na2SO3 + HNO3 →
Решение:
а) CaО + 2HNO3 →Сa(NO3)2 + H2O
CaO + 2H+ + 2NO3– →Ca2+ + 2 NO3– + H2O
CaO + 2H+ →Ca2+ + H2O
CaO + 2H+ + 2NO3– →Ca2+ + 2 NO3– + H2O
CaO + 2H+ →Ca2+ + H2O
б) CaCO3 + 2HNO3 → Сa(NO3)2 + CO2 + H2O
CaCO3 + 2H+ + 2NO3– →Ca2+ + 2 NO3– + CO2 + H2O
CaCO3 + 2H+ →Ca2+ + CO2 + H2O
CaCO3 + 2H+ + 2NO3– →Ca2+ + 2 NO3– + CO2 + H2O
CaCO3 + 2H+ →Ca2+ + CO2 + H2O
в) Cu(OH)2 + 2HNO3 → Сu(NO3)2 + 2H2O
Cu(OH)2 + 2H+ + 2NO3– →Cu2+ + 2 NO3– + 2H2O
Cu(OH)2 + 2H+ →Cu2+ + 2H2O
Cu(OH)2 + 2H+ + 2NO3– →Cu2+ + 2 NO3– + 2H2O
Cu(OH)2 + 2H+ →Cu2+ + 2H2O
г) ZnO + 2HNO3 → Zn(NO3)2 + H2O
ZnO + 2H+ + 2NO3– →Zn2+ + 2 NO3– + H2O
ZnO + 2H+ →Zn2+ + H2O
ZnO + 2H+ + 2NO3– →Zn2+ + 2 NO3– + H2O
ZnO + 2H+ →Zn2+ + H2O
д) NaOH + HNO3 →NaNO3 + H2O
Na+ + OH– + H+ + NO3– → Na+ + NO3– + H2O
OH– + H+ → H2O
Na+ + OH– + H+ + NO3– → Na+ + NO3– + H2O
OH– + H+ → H2O
е) Na2SO3 + 2HNO3 → 2NaNO3 + SO2 + H2O
2Na+ + SO32 – + 2H+ + 2NO3– → 2Na+ + 2NO3– + SO2 + H2O
SO32 – + 2H+ → SO2 + H2O
2Na+ + SO32 – + 2H+ + 2NO3– → 2Na+ + 2NO3– + SO2 + H2O
SO32 – + 2H+ → SO2 + H2O
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
- Запишите уравнения реакций
разложения следующих веществ, укажите условия их протекания:
а) нитрата аммония;
б) нитрита аммония;
в) сульфата аммония;
г) бихромата аммония;
д) хлората аммония.
- Запишите уравнения реакций, при
помощи которых можно осуществить следующие превращения:
N2 → NH3 → NH4NO2 → N2 → NO2 → HNO3 → NO2.
Укажите условия протекания реакций.
- Запишите уравнения реакций
взаимодействия с концентрированной азотной кислотой следующих веществ:
а) углерод;
б) серебро;
в) цинк;
г) фосфор.
- Вычислите объем азотной кислоты
с массовой долей HNO3 в растворе 60 % (плотность
раствора 1,37 г/мл), который можно получить из 10 м3 аммиака.
- Оксид азота (II), полученный
при взаимодействии меди с разбавленной азотной кислотой, подвергли
взаимодействию с расплавом гидроксида калия. Получили42,5 г твердого остатка. Вычислите
массу меди, вступившей в реакцию.
6. Осуществите превращения по схеме:
NH4Cl→ NH3*→
N2 → NO → NO2 → HNO3 → NO2
7.
Сколько
литров и молей аммиака требуется для получения 6,3 кг азотной кислоты, считая
потери в производстве равными 5 %.
8.
Раскаленный
уголек, брошенный в концентрированную азотную кислоту, продолжает гореть, при
этом выделяется бурый газ и газ, образующий с известковой водой Са(ОН)2 белый
осадок. Напишите уравнения реакций.
9.
Нитрат
аммония можно получить взаимодействием нитрата кальция с карбонатом аммония.
Составьте уравнение этой реакции и укажите, почему она идет до конца.
10.
Какова массовая
доля каждой из образующихся солей, если через 300 г 5,6%-го раствора гидроксида
калия пропустили 5,6 л оксида азота (IV).
ВИДЕО ОПЫТ
1.
Оксид азота (IV)
характеризуется свойствами:
|
|
а) все ответы верны
|
б) ядовит
|
в) реагирует с водой
|
г) тяжелее воздуха
|
2.
При
растворении оксида азота (IV) в горячей
воде в отсутствие избытка кислорода образуется:
|
|
а) нет верного ответа
|
б) азотистая кислота
|
в) оксид азота (II)
|
г) оксид азота (I)
|
3.
Металл не
образуется при термическом разложении:
|
|
а) Fe(NO3)3
|
б) AgNO3
|
в) все ответы
верны
|
г) Hg(NO3)2
|
4.
Преимущественно оксид азота (IV) получается при взаимодействии:
|
|
а) кислорода и оксида азота (II)
|
б) серебра с разбавленной азотной
кислотой
|
в) все ответы верны
|
г) азота с кислородом
|
5.
Охарактеризуйте азотную кислоту:
|
|
а) все ответы верны
|
б) термически устойчив
|
в) нелетучая
|
г) сильный окислитель в
концентрированных растворах
|
6.
Какой оксид азота реагирует с медью, если в
результате получено 2,24 л N2 (н.у.)
и 32 г CuO:
|
|
а) NO
|
б) N2O
|
в) NO2
|
г) N2O5
|
7.
Реагируя с какими веществами азотная кислота
проявляет общие свойства кислот:
|
|
а) медью
|
б) оксидом кальция
|
в) все ответы верны
|
г) серой
|
8.
В каком азотном удобрении массовая доля азота
равна 35 %:
|
|
а) мочевина
|
б) аммиачная селитра
|
в) калийная селитра
|
г) натриевая селитра
|
9.
Азотную кислоту можно очистить от примесей серной
с помощью:
|
|
а) хлорида калия
|
б) хлорида бария
|
в) аммиака
|
г) поташа
|
10.
Массовые
доли азота и кислорода в оксиде азота соответственно равны (%) 30,43 и 69,57.
Укажите простейшую формулу оксида:
|
|
а) NO
|
б) N2O
|
в) NO2
|
г) N2O5
|
Ответы:
1
|
а
|
2
|
в
|
3
|
а
|
4
|
а
|
5
|
г
|
6
|
в
|
7
|
б
|
8
|
б
|
9
|
б
|
10
|
в
|















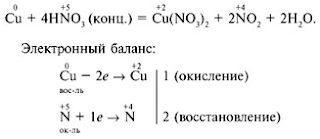





1 комментарий:
Здравствуйте, текст очень большой информативный но хотел бы поравить аммиачная селитра сильный окислитель с органическими веществами, углеродом, магний, алюминий образует взрывчатые смеси но для того чтобы произошла детонация нужен сильный удар к примеру инициирующие взрывчатые вещества.
А также нагревание в замкнутом пространстве когда продукты терморазложения равно не удаляются может произойти взрыв, а также в некоторых случаях в присутствии хлор ионов https://znaesh-kak.com/x/h/аммиачная-селитра.
Как вы уже понимаете просто нагревание даже открытым огнём не приведет ко взрыву, обязательно нужно инициировать взрыв
Отправить комментарий