Раздел 1. Классификация неорганических веществ.
Состав, номенклатура и графические формулы оксидов, оснований, кислот и солей
В
настоящее время известно около 400 тысяч различных неорганических веществ. Все неорганические
вещества можно разделить на классы – оксиды, кислоты, основания и соли. Каждый
класс объединяет вещества, сходные по составу и по свойствам.
Все
неорганические вещества делятся на простые
и сложные.
Простые вещества подразделяются на металлы, неметаллы и инертные газы. Важнейшими классами сложных неорганических веществ являются: оксиды, основания, кислоты, амфотерные гидрокисды, соли.
Оксиды – это соединения двух элементов, один из которых кислород. Общая формула оксидов:
Основания – это сложные вещества, молекулы которых
состоят из атома металла и одной или нескольких гидроксидных групп – ОН. Общая
формула оснований:
Кислоты – это сложные
вещества, содержащие атомы водорода, которые могут замещаться атомами металла.
Общая формула кислот:
где
Ас – кислотный остаток, х – число
атомов водорода, равное валентности кислотного остатка.
Примеры
кислот: НСl, HNO3, H2SO4, H3PO4.
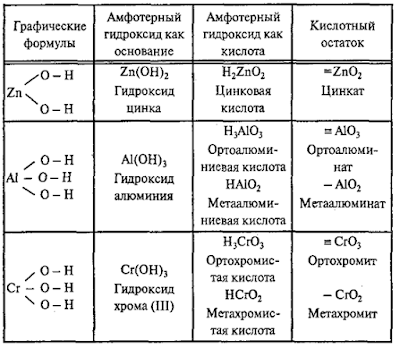
Амфотерные
гидроксиды
– это сложные вещества, которые имеют свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов можно записывать в форме оснований и в
форме кислот.
Примеры
амфотерных гидроксидов:
Соли – это продукты
замещения атомов водорода в молекулах кислот атомами металла или это продукты
замещения гидроксидных групп в молекулах оснований кислотными остатками.
Например:
Состав
нормальных солей выражается общей формулой:
где
х
- число атомов металла; у –
число кислотных остатков.
Примеры
солей: К3РО4, МgSO4, FeCl3.
1.2.
Номенклатура, классификация и графические формулы оксидов
Номенклатура
Называются они просто - "оксид + название элемента"
(см. таблицу). Если валентность химического элемента переменная, то указывается
римской цифрой, заключённой в круглые скобки, после названия химического
элемента.
Формула
|
Название
|
Формула
|
Название
|
CO
|
оксид
углерода ( II )
|
Fe2O3
|
оксид
железа (III )
|
NO
|
оксид
азота ( II )
|
CrO3
|
оксид
хрома (VI )
|
Al2O3
|
оксид
алюминия
|
ZnO
|
оксид
цинка
|
N2O5
|
оксид
азота (V )
|
Mn2O7
|
оксид
марганца (VII )
|
Классификация
оксидов
Все оксиды можно разделить на две группы:
солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или
безразличные.
1). Основные
оксиды – это оксиды, которым соответствуют основания. К основным
оксидам относятся оксиды металлов 1
и 2 групп, а также металлов побочных подгрупп с
валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):
2). Кислотные
оксиды – это оксиды, которым соответствуют кислоты. К кислотным
оксидам относятся оксиды неметаллов (кроме
несолеобразующих – безразличных), а также оксиды металлов побочных
подгрупп с валентностью от V до VII (Например, CrO3-оксид
хрома (VI), Mn 2O7 - оксид марганца (VII)):
3). Амфотерные оксиды –
это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды
металлов главных и побочных подгрупп с
валентностью III, иногдаIV, а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие
оксиды – это оксиды безразличные к кислотам и основаниям. К ним
относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Вывод: характер
свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO (II - основный);
Cr 2O3 (III - амфотерный);
CrO3 (VII - кислотный).
Классификация
оксидов
(по растворимости в воде)
Кислотные оксиды
|
Основные оксиды
|
Амфотерные оксиды
|
Растворимы в воде.
Исключение –SiO2
(не растворим
в воде)
|
В воде растворяются
только оксиды щелочных и щелочноземельных металлов
(это металлы
I «А» и II «А» групп,
исключение Be ,Mg)
|
С водой не
взаимодействуют.
В воде не растворимы
|
Графические
формулы
В
оксидах атомы кислорода связаны только с атомами другого элемента и не связаны
друг с другом. Например:
Номенклатура
По номенклатуре основания называют гидроксидами. Если
валентность химического элемента переменная, то указывается римской цифрой,
заключённой в круглые скобки, после названия химического элемента:
Формула
|
Название
|
Формула
|
Название
|
LiOH
|
гидроксид
лития
|
Ca(OH)2
|
гидроксид
кальция
|
NaOH
|
гидроксид
натрия
|
Cu(OH)2
|
гидроксид
меди(II)
|
KOH
|
гидроксид
калия
|
Fe(OH)3
|
гидроксид
железа(III)
|
Классификация оснований
Графические
формулы
В молекуле
основания атом металла соединяется с атомами кислорода гидроксидных групп.
Например:
Номенклатура
Названия кислородных
кислот образуются от названия элемента с прибавлением окончаний -ная, -вая, если степень окисления его соответствует номеру группы короткой формы Периодической
системы, и слова «кислота». По мере понижения
степени окисления суффиксы меняются в следующем порядке: -оватая, -истая, -оватистая.
Например,
HCl+7O4 – хлорная кислота,
HCl+5O3 – хлорноватая кислота,
HCl+3O2 – хлористая кислота,
HCl+1O – хлорноватистая кислота.
Если элемент в одной и
той же степени окисления образует несколько кислородсодержащих кислот, то к
названию кислоты с меньшим содержанием кислородных атомов добавляется приставка мета-, при наибольшем числе – приставка орто-.
Например,
HBO2 – метаборная кислота, H3BO3 – ортоборная кислота; HPO3 – метафосфорная кислота, H3PO4 – ортофосфорная кислота.
Названия бескислородных
кислот образуются от названия элемента с окончанием на -о и прибавлением слова «водородная».
Например, HF – фтороводородная; HCl – хлороводородная, H2S – сероводородная.
Помимо этих названий, в
русском языке применяются традиционные названия для некоторых важных и часто
применяемых соединений.
Например, HСl – соляная кислота;
HF – плавиковая кислота;
Графические
формулы
В
оксокислотах атомы водорода связаны с атомами кислорода, но не с атомами
кислотообразующего элемента. Например:
В
оксокислотах, молекулы которых содержат 2 и более атомов кислотообразующего
элемента, эти атомы соединяются через атомы кислорода. Например:
Молекулярная
формула любого амфотерного гидроксида может быть записана в форме основания и в
форме кислоты:
1.5.
Номенклатура, классификация и графические формулы солей
Номенклатура
Названия солей
для средней
соли -
название кислотного
остатка + название металла + указываем валентность для металла с переменной
валентностью
Na2SO4- сульфат натрия,
CuSO4-
сульфат меди (II)
для кислой соли
–
«гидро» или
«дигидро» + название кислотного остатка + название металла +
указываем валентность для металла с переменной валентностью
NaHSO4 –
гидросульфат натрия;
NaH2PO4 – дигидроортофосфат натрия
для основной соли –
«гидроксо» + название кислотного остатка + название
металла + указываем валентность для металла с переменной валентностью
Mg(OH)Cl - гидроксохлорид магния
Классификация солей
Нормальные (средние) соли
Нормальные
(средние) соли – это продукты полного замещения атомов водорода в молекуле
кислоты атомами металла, или продукты полного замещениягидроксидных групп в
молекуле основания кислотными остатками. Например:
При
составлении графических формул нормальных солей следует в графических формулах
соответствующих кислот замещать атомы водорода атомами металла с учетом
валентности металла.
Составим
графическую формулу сульфата кальция СаSO4. Эта соль
содержит кислотный остаток серной кислоты Н2SO4:
Составим
графическую формулу сульфата железа (III) Fe2(SO4)3.
Одна молекула этой соли содержит 3 кислотных остатка серной кислоты; один атом
трехвалентного железа замещает 3 атома водорода:
Кислые
соли – это продукты неполного замещения атомов водорода в молекулах
многоосновных кислот атомами металла.
Например:
Двухосновная
кислота с любым металлом образует одну нормальную и одну кислую соль.
Трехосновная кислота с любым металлом образует одну нормальную и две кислые
соли.
Основные
соли – это продукты неполного замещения гидроксидных групп в молекулах
многокислотных оснований кислотными остатками. Например:
Молекулы
основных солей содержат гидроксидные группы:
1.
Классифицируйте
следующие кислоты по основности и по содержанию атомов кислорода: Н3РО4, НNO2, H2S,
HCN, HClO3,
H2CO3,
HF.
Решение:
Одноосновные
кислоты: НNO2, HCN,
HF, HClO3
Двухосновные
кислоты: H2S, H2CO3
Трехосновные
кислоты: Н3РО4
Бескислородные
кислоты: H2S, HCN, HF
Кислородсодержащие
кислоты: Н3РО4, НNO2, HClO3, H2CO3
____________________________________________________________
2.
Классифицируйте
и назовите следующие соли: BaSO4,
(CuOH)2SO4, NaH2PO4, Ca(HS)2, FeOHCl2, AlPO4, MnOHNO3.
Решение:
Нормальные
соли: BaSO4
– сульфат бария, AlPO4
–
фосфат алюминия.
Кислые
соли: NaH2PO4
– дигидрофосфат натрия, Ca(HS)2 – гидросульфид
кальция.
Основные
соли: (CuOH)2SO4 –
гидроксосульфат меди (II),
FeOHCl2
–
гидроксохлорид железа (III),
MnOHNO3
–
гидроксонитрат марганца (II).
____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
2. Составьте формулы
предложенных веществ:
Оксид калия, оксид серы (VI), гидроксид
магния, гидроксид меди (II), оксид бария, оксид азота (II), оксид цинка,
гидроксид натрия, оксид фосфора (III), оксид углерода (II), оксид
углерода (IV), оксид алюминия.
3. Классифицируйте соли (средние
(нормальные), кислые, основные):
Na2CO3; K2SO4; AI(OH)CI;
NaHCO3; Ba(NO3)2; Ca(HCO3)2;
K3PO4; Ca(OH)CI; KH2PO4.
4. Классифицируйте следующие
кислоты по основности и по содержанию атомов кислорода:
HI, H2S, HNO2, HMnO4, H2CO3.
5.
Напишите формулы и названия
оксидов, гидратами которых являются следующие кислоты: H2SiO3, HNO2, H2CrO4, H3PO4, H2MnO4.
6.
Определите валентность
кислотообразующих элементов в следующих кислотах и напишите графические формулы
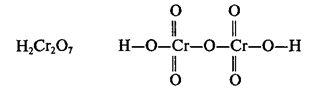
этих кислот: HClO, H2Cr2O7,
H4P2O7.
7.
Напишите формулы следующих
амфотерных гидроксидов в форме кислот и определите валентность кислотных
остатков в этих кислотах: Cr(OH)3, Sn(OH)2, Pb(OH)2.
8.
Классифицируйте и назовите
следующие соли:
9.
Напишите молекулярные и графические
формулы следующих солей: а) дигидрофосфат натрия; б) сульфат алюминия; в) гидроксосульфат цинка; г) бромид железа (III);
д) перманганат калия.
10. Напишите молекулярные и графические формулы
нормальных солей, которые могут быть получены в результате замещения в молекуле
амфотерного гидроксида Zn(OH)2: а) гидроксидных групп кислотными остатками
азотной кислоты; б) атомов водорода
атомами натрия. Назовите эти соли.
|
1.
К амфотерным
оксидам относится:
|
|
|
1. а) CuO
|
2. б) P2O3
|
|
3. в) Cr2O3
|
4. г) CrO3
|
|
2.
Среди перечисленных веществ
кислой солью является:
|
|
|
1. а) гидрид магния
|
2. б) гидрокарбонат натрия
|
|
в) гидроксид
кальция
|
3. г) гидроксокарбонат меди
|
|
3.
Какой из элементов может
образовать кислотный оксид:
|
|
|
1. а) Стронций
|
2. б) марганец
|
|
3. в) кальций
|
г) магний
|
|
4.
Оксид серы (VI) взаимодействует с
каждым из двух веществ:
|
|
|
1. а) водой и соляной кислотой;
2.
|
3. б) кислородом и оксидом магния
|
|
4. в) оксидом кальция и гидроксидом
натрия
|
5. г) водой и медью
|
|
5.
Гидроксид железа (III) образуется
при действии растворов щелочей на:
|
|
|
1. а) оксид железа (II);
|
б) оксид
железа (III)
|
|
в) растворы
солей железа (II)
|
г) растворы
солей железа (III)
|
|
6.
Хлорид железа (II) реагирует с
каждым из двух веществ:
|
|
|
1. а) MgO , HCl
|
2. б) Zn , AgNO3
|
|
3. в) HNO3, CO2
|
г) CaO, CO2
|
|
7.
В схеме превращений CaCO3 → X1 → X2 + NaCl
веществом Х2 является:
|
|
|
1. а) CaCO3
|
2. б) CaCl2
|
|
3. в) CaO
|
4. г) Ca(OH)2
|
|
8.
К основным оксидам относится:
|
|
|
1. а) ZnO
|
2. б) SiO2
|
|
3. в) BaO
|
4. г) l2O3
|
|
9.
Высший оксид элемента с
порядковым номером 16 относится к оксидам:
|
|
|
1. а) основным
|
2. б) кислотным
|
|
3. в) амфотерным
|
4. г) несолеобразующим
|
|
10.
Оксид углерода (IV)
реагирует с каждым из двух веществ:
|
|
|
1. а) водой и оксидом кальция
|
2. б) кислородом и оксидом серы (IV)
|
|
3. в) сульфатом калия и гидроксидом
натрия
|
4. г) фосфорной кислотой и водородом
|
Ответы:
|
1
|
в
|
|
2
|
б
|
|
3
|
б
|
|
4
|
в
|
|
5
|
г
|
|
6
|
б
|
|
7
|
а
|
|
8
|
в
|
|
9
|
б
|
|
10
|
а
|

































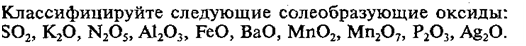
Комментариев нет:
Отправить комментарий