7.3.
Общая характеристика металлов
Металлы – это химические
элементы, атомы которых легко отдают электроны внешнего (а некоторые и
предвнешнего) электронного слоя, превращаясь в положительные ионы.
Типичными металлами являются щелочные и щелочноземельные металлы, которые характеризуются небольшим (1-2) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий, германий, олово, свинец и сурьма проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства. Подобное поведение характерно и для большинства элементов побочных подгрупп.
Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7-1,9) и исключительно восстановительные свойства, то есть способность отдавать электроны.
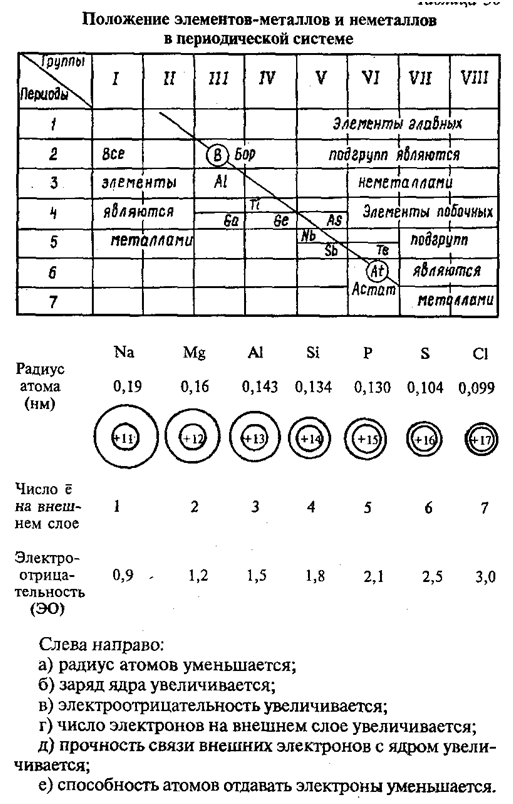
В главных подгруппах периодической системы металлы находятся ниже диагонали бор-астат, а также в побочных подгруппах. В периодах и главных подгруппах действуют закономерности в изменении металлических, а значит, восстановительных свойств элементов.
Типичными металлами являются щелочные и щелочноземельные металлы, которые характеризуются небольшим (1-2) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий, германий, олово, свинец и сурьма проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства. Подобное поведение характерно и для большинства элементов побочных подгрупп.
Для атомов металлов характерны небольшие значения электроотрицательности (от 0,7-1,9) и исключительно восстановительные свойства, то есть способность отдавать электроны.
В главных подгруппах периодической системы металлы находятся ниже диагонали бор-астат, а также в побочных подгруппах. В периодах и главных подгруппах действуют закономерности в изменении металлических, а значит, восстановительных свойств элементов.
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от
бериллия к астату, то слева внизу по диагонали будут находиться
элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа
вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al,
Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Общие свойства металлов.
Виды кристаллических решеток
Кристаллические решетки металлического типа содержат в узлах положительно
заряженные ионы и нейтральные атомы; между ними передвигаются относительно
свободные электроны.
Физические
свойства:
Все металлы – твердые вещества (кроме ртути, которая при обычных условиях жидкая); вид связи – металлическая; обладают характерным металлическим блеском. Валентные электроны слабо связаны с конкретным атомом и в кристалле металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (то есть они – проводники), особенно медь, серебро, золото, ртуть и алюминий; высока и теплопроводность металлов. Многие металлы обладают пластичностью (например, олово, алюминий), ковкостью.
Химические свойства:
Восстановительная способность. Щелочные металлы на воздухе сразу
окисляются (даже самовоспламеняются), поэтому их хранят под слоем керосина или
парафина. При окислении щелочных металлов, как правило, образуются не оксиды, а
пероксиды металлов:
2Na + O2 = Na2O2
Другие металлы окисляются медленно при
обычной температуре или при нагревании с образованием оксидов:
4Al + 3O2 = 2Al2O3
Серебро, золото и платина не окисляются
даже при нагревании.
Металлы взаимодействуют при тех или иных условиях с неметаллами:
Металлы взаимодействуют при тех или иных условиях с неметаллами:
Fe + S = FeS
Взаимодействие с водой. Активные щелочные и щелочно-земельные
металлы с водой реагируют очень бурно с выделением водорода и образованием
щелочи:
2Na + 2HOH = 2NaOH + H2
Менее активные металлы вытесняют водород
из воды при нагревании.
Металлы, стоящие в электрохимическом ряду напряжений металлов за водородом, с водой не взаимодействуют.
- взаимодействие с кислотами. Металлы, находящиеся в ряду напряжений левее водорода вытесняют водород из растворов соляной и разбавленной серной кислот:
Металлы, стоящие в электрохимическом ряду напряжений металлов за водородом, с водой не взаимодействуют.
- взаимодействие с кислотами. Металлы, находящиеся в ряду напряжений левее водорода вытесняют водород из растворов соляной и разбавленной серной кислот:
Zn + HCl = ZnCl2 + H2
При
взаимодействии металлов с азотной и концентрированной серной кислотами водород
никогда не выделяется. В зависимости от активности металла, степени
концентрации кислоты и условий проведения реакции эти кислоты могут
восстанавливаться до соединений, имеющих различную степень окисления.
При взаимодействии металлов (в зависимости от активности металла) с концентрированной H2SO4продуктами восстановления серной кислоты могут быть: SO2, S, H2S. Железо пассивируется.
Со щелочами могут реагировать металлы, оксиды и гидроксиды которых амфотерны (Zn, Al, Sn). При этом выделяется водород:
При взаимодействии металлов (в зависимости от активности металла) с концентрированной H2SO4продуктами восстановления серной кислоты могут быть: SO2, S, H2S. Железо пассивируется.
Со щелочами могут реагировать металлы, оксиды и гидроксиды которых амфотерны (Zn, Al, Sn). При этом выделяется водород:
Zn + 2NaOH = Na2ZnO2 + H2
или более точная запись:
Zn +
2NaOH + H2O = Na2[Zn(OH)4] + H2
При взаимодействии металлов с азотной
кислотой водород не выделяется, происходит восстановление N+5. B
зависимости от активности металла и степени разбавления HNO3,
продуктами могут быть: NO2, NO, N2O, N2, NH4NO3.
Взаимодействие с солями. При взаимодействии с водными растворами солей металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее от них:
Взаимодействие с солями. При взаимодействии с водными растворами солей металлы, находящиеся в электрохимическом ряду напряжений металлов левее, восстанавливают металлы, находящиеся в этом ряду правее от них:
Fe + CuSO4 = Cu↓ + FeSO4
Металлы с сильными восстановительными свойствами (Li, Na, K, Ca и
др ) в этих условиях будут восстанавливать водород воды, а не металл
соответствующей соли.
Способы получения металлов:
Пирометаллурия – получение металлов из руд с помощью реакций восстановления, проводимых при высоких температурах.
Способы получения металлов:
Пирометаллурия – получение металлов из руд с помощью реакций восстановления, проводимых при высоких температурах.
2ZnS + 3O2 = 2ZnO + 2SO2↑
Восстановление углем (коксом) – проводят если металл совсем не
образует карбидов или образует непрочные карбиды:
Cu2O + C = 2Cu + CO↑
Восстановление металла водородом (применяется в промышленных
масштабах):
MoO3 + 3H2 = Mo + 3H2O
Металлотермия, например алюмотермия:
Cr2O3 + 2Al = Al2O3 + 2Cr
Гидрометаллургия (получение металлов из растворов их солей):
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = Cu + FeSO4
CuSO4 + Fe = Cu + FeSO4
Электрометаллургия – электролиз –
окислительно-восстановительный процесс протекающий при прохождении
электрического тока через раствор или расплав электролита:
2NaCl → 2Na + Cl2↑
2NaCl → 2Na + Cl2↑
Основные промышленные способы получения металлов:
1. Пирометаллургический:
1)
коксотермия
Fe2O3 + 3CO → 2Fe + 3CO2
Fe(CO)3 → Fe + 3CO
2)
алюмотермия
Fe2O3 + 2Al → 2Fe + Al2O3
3)
магнийтермия
TiO2 + 2Mg → Ti + 2MgO
4)
водородотермия
CuO + H2 → Cu + H2O
2. Электрохимический:
1) электролиз
расплавов: NiCl2 → Ni + Cl2
2) электролиз
растворов: MnSO4 + 2H2O → Mn + O2
+ H2 + H2SO4
3.
Гидрометаллургический:
Cu + 2H2SO4 →
CuSO4 + SO2 + 2H2O
CuSO4 + Fe → Cu +
FeSO4.
Коррозия – это самопроизврольный процесс
разрушения металлов при ввзаимодействии их с окружающей средой,
например, железо на воздухе: 4Fe + 3O2 + 6H2O → 4Fe(OH)3
Коррозия наносит большой ущерб
народному хозяйству. Поэтому с коррозией ведут борьбу.
Существуют следующие методы защиты
металлов от коррозии.
1. Исключение контакта металла с
атмосферой и электролитами. Это может быть достигнуто нанесением защитных покрытий:
а) неметаллических –
специальные лаки, краски, эмали;
б) химических –
покрытий, к которым относятся искуственно создаваемые поверхностные пленки
(оксидные, фосфатные, нитридные и др.);
в) металлических – покрытий,
полученных электрохимическим осаждением на защищаемой детали тонкого слоя
другого металла (хромирование, никелирование, цинкование, лужение и т.д.);
2. Электрохимические методы защиты:
а) протекторная – к
защищаемому металлу присоединяется кусок более активного металла, который и
разрушается в присутствии электролита;
б) катодная
– металлоконструкции подсоединяются к катоду внешнего источника тока, что
исключает возможность их анодного разрушения.
3. Специальная обработка электролита
или среды, в которой
находится защищаемая конструкция:
а) введение веществ-ингибиторов,
замедляющих коррозию;
б) удаление растворенного воздуха в
воде (деаэрация) – например, в воде, поступающей в котельные установки.
Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических
элементов с преобладанием
металлических компонентов.
Сплавы состоят из основы (одного или нескольких
металлов), малых добавок, специально вводимых в сплав легирующих и модифицирующих элементов, а также из неудалённых
примесей (природных, технологических и случайных).
Сплавы являются одним из основных конструкционных
материалов. Среди них наибольшее значение имеют сплавы на основе железа и алюминия. В технике применяется более 5 тыс. сплавов.
УПРАЖНЕНИЯ
1. 2 г
сплава меди с алюминием обработали раствором щелочи. Остаток растворили в
разбавленной азотной кислоте, образовавшуюся при этом смесь выделили и
прокалили. Масса остатка после прокаливания составила 0,8 г. Определите
объем израсходованного 40%-го раствора гидроксида натрия (плотность
1,22 г/мл) и содержание металлов в сплаве.
Решение:
Для решения задачи необходимо знать химические
свойства меди и алюминия. Медь обладает металлическими свойствами и не
реагирует со щелочами. С раствором гидроксида натрия будет реагировать только
алюминий, который проявляет амфотерные свойства:
2Al + 2NaOH + 6H2O
= 2Na[Al(OH)4] + H2 (1)
Остатком является медь, которую растворили в
разбавленной азотной кислоте:
3Cu + 8HNO3 =
3Cu(NO3)2 + 2NO + 4H2O (2)
После выделения и прокаливания смеси образуется оксид
меди (II):
2Cu(NO3)2 =
2CuO + 4NO2 + O2 (3)
Определим массу меди в исходной смеси. Для этого
найдем количество вещества оксида меди (II), по условию задачи его масса
равна 0,8 г:
(моль).
По уравнению (3) 2 моль оксида меди (II)
образуется из 2 моль нитрата меди (II), (соотношение n(CuO)
: n(Cu(NO3)2) = 1 : 1), следовательно,
0,01 моль оксида меди (II) образуется из 0,01 моль нитрата
меди (II). По уравнению (2) из 3 моль меди дает 3 моль нитрата
меди (II) (соотношение n(Cu) : n(Cu(NO3)2)
= 1 : 1), тогда для образования 0,01 моль нитрата меди (II)
необходимо 0,01 моль меди. Количество вещества меди равно 0,01 моль.
Рассчитаем массу меди в исходной смеси:
m = n · M = 0,01 · 64 = 0,64 г.
По условию задача масса смеси равна 2 г,
определим массу алюминия:
m(Al) = m(смеси) – m(Cu) = 2 –
0,64 = 1,36 (г).
Рассчитаем массовые доли металлов в смеси:
(%);
(%).
Для определения объема израсходованного раствора
гидроксида натрия, необходимо определить количество вещества NaOH вступившего
во взаимодействие с алюминием. По уравнению реакции (1) 2 моль Al
реагирует с 2 моль NaOH (соотношение n(Al) : n(NaOH)
= 1 : 1). Количество вещества алюминий равно:
моль,
следовательно, количество вещества n (NaOH)
= 0,05 моль.
Определим массу гидроксида натрия:
m (в-ва) = n · M =
0,05 · 40 = 2 (г).
Вычислим массу раствора гидроксида натрия, зная
массовую долю NaOH в растворе:
(г).
Определим объем раствора 40%-го раствора гидроксида
натрия необходимый для взаимодействия:
(мл).
Ответ: V (p-pa NaOH) = 4,1 мл; ω (Cu) = 32%, ω (Al)
= 68%.
_________________________________________________________________
2. При взаимодействии металлического натрия с водой
выделилось 280 мл водорода (при н. у.). Сколько граммов натрия вступило в реакцию?
Решение:
Запишем уравнение реакции
взаимодействия натрия с водой:
2 Na + 2 H2O
= 2 NaOH + H2
|
|||
46
|
36
|
80
|
22,4
|
Из уравнения
следует, что 2 моля натрия (2·23 г) вытесняют из воды 1 моль водорода (22,4 л
при н. у.). Количество вступившего в реакцию натрия можно найти по пропорции
46 г натрия
вытесняет из воды 22,4 л водорода,
а х г натрия
--- 0,28 л
х =
46·0,28/22,4 = 0,575 г.
_________________________________________________________________
3. Какие металлы и в какой
последовательности будут вытесняться, если железную пластинку погрузить в
раствор, содержащий одновременно NiSO4, CuSO4, K2SO4,
Ag2SO4 и
MgSO4 ?
Решение:
Железо будет вытеснять металлы из растворов их
солей в такой последовательности:
1) сульфат серебра(I); 2) сульфат меди(II); 3) сульфат никеля. Остальные металлы вытесняться не будут.
1) сульфат серебра(I); 2) сульфат меди(II); 3) сульфат никеля. Остальные металлы вытесняться не будут.
_________________________________________________________________
4. Железная пластинка массой 18 г была
погружена в раствор сульфата меди(II). Когда она покрылась медью, ее масса
стала равной 20 г. Какая масса железа перешла в раствор?
Решение:
Составим
уравнение реакции:
Fe + CuSO4 = FeSO4 + Cu.
Обозначим
через х количество вещества (железа и меди) в
моль.
Составим баланс изменения массы веществ для пластинки:
Составим баланс изменения массы веществ для пластинки:
18 – 56х + 64х = 20.
Из этого
уравнения х = 0,25 моль. Следовательно, в раствор
перешло железо массой 14 г
(m(Fe) = x•M(Fe) = 0,25•56 = 14 г).
(m(Fe) = x•M(Fe) = 0,25•56 = 14 г).
_________________________________________________________________
5. Для извлечения
серебра из раствора, содержащего его растворимые соли, раствор прокипятили с
гранулированным цинком, после чего масса металла возросла на 7,5 г. Какое
количество серебра по массе было извлечено из раствора?
Решение:
2АgA + Zn = ZnA2 + 2Ag,
где А –
одновалентный анион.
Масса пластинки увеличилась за счет того, что в раствор уходил цинк, а приходило серебро. В математическом виде это можно представить так: –Zn + Ag = m.
Пусть х – количество вещества цинка в моль, тогда:
Масса пластинки увеличилась за счет того, что в раствор уходил цинк, а приходило серебро. В математическом виде это можно представить так: –Zn + Ag = m.
Пусть х – количество вещества цинка в моль, тогда:
–65х + 216х = 7,5 г.
Отсюда х = 0,05 моль. Масса извлеченного
серебра: 0,05•216 = 10,8 г.
_________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Какие химические свойства характерны для металлов.
2.
Сколько электронов имеют атомы металлов на внешнем
электронном слое.
3.
Как различаются сплавы по своему строению.
4.
Что такое коррозия? Какие виды коррозии вы знаете.
5.
С растворами каких из указанных солей:
-
может реагировать железо? Напишите уравнения реакций в молекулярном и ионном
видах.
6.
При взаимодействии 8 г смеси железа и магния с
соляной кислотой выделилось 4,48 л водорода (н.у.). Сколько граммов железа и
магния содержалось в смеси.
7.
При обработке 8 г смеси магния и оксида магния
соляной кислотой выделилось 5,6 л водорода (н.у.). Какова массовая доля (в %)
магния в исходной смеси.
8.
Какой объем
(при н.у.) оксида углерода (II) необходим для
полного восстановления 320 г оксида железа (III).
9.
Сколько граммов алюминия необходимо взять для
получения 78 г хрома из его оксида (Cr2O3).
10.
Между какими
из попарно взятых веществ произойдет химическая реакция? Напишите уравнения
реакций в молекулярном и ионных видах:
ВИДЕО ОПЫТ
1.
Металлы хорошо проводят электрический ток,
поскольку:
|
|
а) связь в металлах ионного типа
|
б) ионы металлов обладают высокой
подвижностью
|
в) электроны в металлах обладают
высокой подвижностью
|
г) связь в металлах ковалентная
|
2.
Отметьте химический символ металла с наибольшим
радиусом атома:
|
|
а) K
|
б) Ca
|
в) Zn
|
г) Rb
|
3.
Гидроксид какого металла обладает наименее
выраженными основными свойствами:
|
|
а) Li
|
б) K
|
в) Be
|
г) Ca
|
4.
Символы ионов, обладающих наиболее и наименее
сильными окислительными свойствами в водных растворах соответственно
приведены в ряду:
|
|
а) Au3+
и K+
|
б)Au3+ и Li+
|
в)Cu2+ и Li+
|
г)Li+ и Au3+
|
5.
Все металлы какого ряда реагируют с соляной
кислотой:
|
|
а) Zn, Fe, Mg
|
б) Fe, Al, Pt
|
в) Ni, Cr, Au
|
г) Sn, Mg, Hg
|
6.
Какой металл можно использовать для получения
цинка восстановлением его катиона в водном растворе соли:
|
|
а) Ca
|
б) Mg
|
в) Fe
|
г) K
|
7.
Металл массой 13,7 г, образующий двухзарядный
катион, реагируя с водой выделяет 2,24 л газа (н.у.). Укажите символ металла:
|
|
а) Mg
|
б) Ca
|
в) Ва
|
г) Nа
|
8.
В каком ряду приведены символы соответственно самого твердого и самого тугоплавкого
металлов:
|
|
а)W, Ti
|
б) Cr, Hg
|
в) Cr, W
|
г) W, Cr
|
9.
Отметьте формулу оксида металла с наиболее
выраженными кислотными свойствами:
|
|
а) K2O
|
б)MnO
|
в) Cr2O3
|
г)Mn2O7
|
10.
Какой
минимальный объем (л, н.у.) оксида углерода (II)
нужен для восстановления 320 г оксида железа (III)
до магнетита:
|
|
а) 14,93
|
б) 15,48
|
в) 20,12
|
г) 11,75
|
Ответы:
1
|
в
|
2
|
г
|
3
|
в
|
4
|
б
|
5
|
а
|
6
|
б
|
7
|
в
|
8
|
в
|
9
|
г
|
10
|
а
|













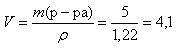


Комментариев нет:
Отправить комментарий