7.6.
Железо и его соединения
Железо – химический элемент четвертого периода и побочной подгруппы
VIII группы периодической системы. Атом железа содержит восемь валентных
электронов, однако в соединениях железо обычно проявляет степени окисления (+2)
и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного
железа.
Степень
окисления +3 для железа является наиболее устойчивой. Соединения железа(III)
могут быть восстановлены только под действием сильных восстановителей, таких как
водород в момент выделения, сероводород. Эти реакции проводят в кислой среде:
Fe2(SO4)3+H2S=2FeSO4+S+H2SO4
Железо
широко распространено в природе – это самый распространенный металл, после
алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком
состоит из железа с примесью никеля и серы, а возможно и других
элементов.
В природе
железо встречается в
виде руд - оксидов Fe2O3 (гематит,
красный железняк) и Fe3O4 (магнетит, магнитный
железняк), гидратированного оксида Fe2O3⋅H2O
(лимонит, бурый железняк), карбоната FeCO3 (сидерит),
дисульфида FeS2 (пирит), редко встречается в виде самородков,
попадающих на землю с метеоритами. Такое метеоритное железо было известно людям
издревле. Освоение получения железа из железной руды послужило началом
железного века.
ПОЛУЧЕНИЕ ЖЕЛЕЗА
В настоящее
время железную руду восстанавливают коксом в доменных печах, при этом
расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C
(цементит), а частично растворяет его. При затвердевании расплава образуется
чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При
получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь.
Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный
кислородом. Существует и прямой метод получения железа, основанный на
восстановлении окатышей магнитного железняка природным газом:
Fe3O4 +
CH4 = 3Fe + CO2 + 2H2O
ФИЗИЧЕСКИЕ
СВОЙСТВА
Железо –
серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип.
2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть
обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в
структуре металла отдельных зон – доменов, магнитные моменты которых под
действием внешнего магнитного поля ориентируются в одну и ту же сторону.
Железо существует в форме нескольких полиморфных (аллотропных) модификаций.
При температурах ниже 9100C устойчиво железо с объемно-центрированной
кристаллической решеткой (αα-Fe, немагнитное α-железо существующее
при 769–9100C называют β-Fe), в интервале
температур 910–14000C – более плотная модификация с кубической
гранецентрированной (γγ-Fe), а выше этой температуры и вплоть до температуры
плавления вновь становится устойчивой структура с объемно-центрированной
ячейкой (δ-Fe).
ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
Запомнить!
·
Степень
окисления +2 железо проявляет при взаимодействии со
слабыми окислителями: серой, йодом, соляной кислотой, растворами
солей.
·
Степень
окисления +3 железо проявляет при взаимодействии с
сильными окислителями: хлором, бромом.
·
Смешанную
степень окисления железо проявляет при взаимодействии с кислородом,
водяным паром.
1) с кислотами. На влажном воздухе окисляется, покрываясь
коричневой коркой гидратированного оксида Fe2O3⋅H2O,
ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl2 + H2
но пассивируется в холодных концентрированных
растворах кислот-окислителях – серной и азотной.
2) с солями.Будучи металлом средней химической активности, железо
вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO4= FeSO4 + Cu
При этом, как и при растворении в кислотах, образуются
соли двухвалентного железа.
3) с парами воды.При температуре белого каления железо реагирует с
водой. Пропуская перегретый водяной пар через раскаленный на жаровне
чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H2O = Fe3O4 +
4H2.
4) с кислородом.В кислороде железо сгорает с образованием черyого
порошка железной окалины – оксида железа(II, III) Fe3O4,имеющей
тот же состав, что и природный минерал магнитный железняк:
3Fe + 2O2 = Fe3O4
Искры, вырывающиеся при заточке стальных ножей или при
резке стальных листов ацетилено-кислородным пламенем, также представляют собой
раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в
образующихся соединениях зависит от силы окислителя - неметалла. Так, при
взаимодействии с хлором образуется хлорид FeCl3:
2Fe + 3Cl2 = 2FeCl3,
с
серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и
гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями
и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO4 +
O2 + 2H2O = 4Fe(OH)SO4.
Белый осадок гидроксида железа(II) Fe(OH)2,
образующийся при действии на соли железа(II) растворов щелочей, на воздухе
мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II)
и железа(III), который лишь через некоторое время приобретает характерный для
Fe2O3⋅H2O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого
осадка при действии растворов щелочей, сульфидов, карбонатов на соли
железа(III):
2FeCl3 +
3Na2CO3 + 6H2O = 2Fe(OH)3 +3CO2+
6NaCl
Запомнить! Оксид и
гидроксид железа(III) являются слабо амфотерными, с преобладанием основных
свойств.
Так, при
растворении гидроксида железа(III) в кислотах образуются соли железа(III), а
при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)3 +
2H2SO4 = Fe2(SO4)3 +
3H2O,
Fe2O3 + CaO = CaFe2O4.
В концентрированных щелочах Fe(OH)3 медленно
растворяется, образуя гидроксоферраты, например, Na3[Fe(OH)6]:
Fe(OH)3+3NaOHводн.=Na3[Fe(OH)6]
При действии
недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
Na3[Fe(OH)6]+3HClнед.=3NaCl+Fe(OH)3↓+3H2O
Na3[Fe(OH)6]+6HClизб.=3NaCl+FeCl3+6H2O
При пропускании углекислого газа они разлагаются
на гидроксид железа(III) и карбонат натрия:
2Na3[Fe(OH)6]+3CO2↑=3Na2CO3+2Fe(OH)3↓+3H2O
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и
угольной не могут быть выделены из водных растворов по причине полного
необратимого гидролиза:
2FeCl3+3Na2S+6H2O=2Fe(OH)3+3H2S↑+6NaCl
О протекании реакции судят по выделению газа и
образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной
среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)3 +
3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O.
Запомнить! Ферраты
содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде
чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид
железа(III) используется при травлении медных плат, а сульфат железа(III) – в
качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты
двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели
применяют в радиоэлектронике, вычислительной технике.
Соли
железа(III) образуют желто-коричневые растворы, цвет которых объясняется
гидролизом, приводящим к образованию коллоидного раствора гидроксида
железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное
железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках,
отсыревают.
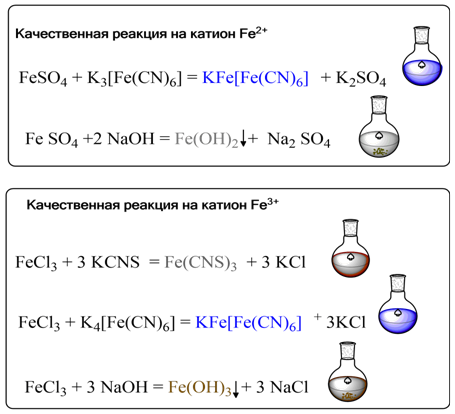
Качественные реакции на катионы
железа
На ионы
железа существуют удобные качественные реакции. Если к раствору соли
железа(III) прибавить разбавленный раствор роданида калия KCNS, то
образуется интенсивно-красное окрашивание, вызванное образованием роданида
железа(III):
FeCl3+3KSCN=Fe(SCN)3+3KCl
Другим
реагентом на ионы железа(III) служит комплексное соединение
гексацианоферрат(II) калия K4[Fe(CN)6], часто называемый также
"желтая кровяная соль". Такое странное на первый взгляд название
связано с тем, что раньше эту соль получали нагреванием крови с поташом и
железными опилками. С солями железа(III) она дает синий коллоидный
раствор «берлинской лазури» или "турнбуллева синь":
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓+3KCl
.
Аналогичное синие окрашивание осадка того же состава
можно получить при взаимодействии ионов железа(II) с раствором "красной
кровяной соли" - гексацианоферрат(III) калия K3[Fe(CN)6]:
K3[Fe(CN)6]+FeCl2=KFe[Fe(CN)6]↓+2KCl
Таким
образом, красная кровяная соль служит реактивом на соли двухвалентного железа.
При более высоких концентрациях растворов выделяется нерастворимая в воде форма
«берлинской лазури» состава Fe4[Fe(CN)6]3.
УПРАЖНЕНИЯ
1.
Соль, полученную при растворении железа
в горячей концентрированной серной кислоте, обработали избытком
раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и
прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Решение:
Написаны
четыре уравнения описанных реакций:
1) 2Fe
+ 6H2SO4 → Fe2 (SO4)3 + 3SO2↑ +6H2O
2) Fe2
(SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
3) 2Fe(OH)3 → Fe2O3 + 3H2O
4) Fe2O3 + Fe → 3 FeO
_________________________________________________________________
2.
Смесь алюминия и железа обработали
избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же
количество смеси обработали избытком раствора гидроксида натрия, выделилось
6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Решение:
1) Составим
уравнения реакций взаимодействия металлов с
кислотой и
щелочью, при этом нужно учесть, что железо не реагирует с
раствором щелочи:
2Al + 6HCl =
2AlCl3+ 3H2 ↑ (1)
2моль 3моль
Fe + 2HCl = FeCl2 +H2↑ (2)
1моль 1моль
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4]
+ 3H2↑ (3)
2моль 3моль
2) Поскольку
со щелочью реагирует только алюминий, то мож-
но найти его
количество вещества:
ν(Н2)
= V/VM = 6,72 (л) / 22,4 (л/моль) = 0,3
моль,
следовательно, ν(Al) =
0,2 моль.
3) Поскольку
для обеих реакций были взяты одинаковые количества смеси, то в реакцию с
соляной
кислотой вступило такое же количество алюминия, как и в реакцию со щелочью,
– 0,2 моль.
По уравнению
(1) находим:
ν(Н2)
= 0,3 моль.
4) Найдем
количество вещества водорода, выделившегося в результате реакции металлов с
кислотой:
νобщ(Н2)
= V / VМ = 8,96 (л) / 22,4
(л/моль) = 0,4 моль.
5) Найдем
количество вещества водорода, выделившегося при взаимодействии железа с
кислотой, и затем количество вещества железа:
ν(Н2)
= νобщ(Н2) – ν(Н2) = 0,4 – 0,3 = 0,1 моль,
ν(Fe) = 0,1
моль.
6) Найдем
массы Al, Fe, массу смеси и массовую долю железа в смеси:
m(Al) = 27 (г/моль) * 0,2 (моль) =
5,4 г,
m(Fe) = 56 (г/моль) * 0,1 (моль) =
5,6 г,
mсмеси(Al, Fe) = 5,4 + 5,6 = 11 г,
ω(Fe) = mв-ва / mсм =
5,6 / 11 = 0,5091 (50,91 %).
Ответ. ω(Fe) = 50,91 %.
_________________________________________________________________
3. Напишите уравнения
реакций железа с простыми веществами: кислородом, хлором, серой, бромом.
Назовите образующиеся вещества.
Решение:
_________________________________________________________________
4. Как доказать, что
в одном из двух растворов есть ионы Fe2+, а в другом — ионы Fe3+?
Напишите уравнения протекающих реакций.
Решение:
_________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Изобразите схему строения атома
железа. Укажите степени окисления, которые железо проявляет в соединениях.
2.
Вычислите массовые доли железа в
соединениях: FeO, Fe2O3,
Fe3O4.
В каком из этих соединений массовая доля железа наибольшая.
3.
Как можно получить гидроксид железа
(II) из железа? Напишите
уравнения реакции.
4.
Как можно получить гидроксид железа
(III) из железа?
Напишите уравнения реакции.
5.
Как получить из сульфата железа (II) хлорид железа (II) и нитрат железа (II). Напишите
уравнения реакции.
6.
К раствору смеси хлорида железа (III) и хлорида алюминия добавили избыток раствора
гидроксида натрия. Какое вещество
выпадает в осадок, какие вещества остаются в растворе? Ответ поясните
уравнениями реакций.
7.
Минерал содержит 72,36% железа и
27,64% кислорода. Определите формулу минерала.
8.
Сколько граммов сульфата железа (II) можно получить при
растворении 140 г железа в разбавленной серной кислоте.
9.
Напишите молекулярные и ионные
уравнения реакций следующих превращений:
10.
Методом
электронного баланса составьте уравнения реакций, протекающих по следующим
схемам:
ВИДЕО ОПЫТ
1.
Укажите последовательность восстановления оксидов
железа в доменной печи:
|
|
а) FeO→Fe3O4→
Fe2O3→Fe
|
б) Fe3O4→Fe2O3→ FeO→Fe
|
в) Fe2O3→Fe3O4→ FeO→Fe
|
г) Fe3O4→FeO→ Fe2O3→Fe
|
2.
Число неспаренных электронов в основном состоянии
атома железа равно:
|
|
а) 2
|
б) 4
|
в) 3
|
г) 1
|
3.
Железо нельзя получить по реакции:
|
|
а) Fe3O4 + С→
|
б) Fe(OН)3
→
|
в) FeSO4 (p-p) + Zn →
|
г) Fe2O3 + H2 →
|
4.
С водными растворами каких веществ реагирует
железо:
|
|
а) хлорид калия
|
б) нитрат кальция
|
в) хлороводород
|
г) все ответы верны
|
5.
Гидроксид железа (II)
можно получить взаимодействием:
|
|
а) оксида железа (II) и воды
|
б) все ответы верны
|
в) сульфата железа (II) и гидроксида натрия
|
г) гидроксида железа (III) с влажным воздухом
|
6.
Для превращения магнетита в оксид железа (III) необходимо, чтобы магнетит прореагировал с:
|
|
а) водородом
|
б) кислородом
|
в) оксидом углерода (II)
|
г) коксом
|
7.
В каком из природных соединений железа его
массовая доля наибольшая:
|
|
а) магнетит
|
б) гематит
|
в) пирит
|
г) сидерит
|
8.
В отличие от гидроксида железа (III) гидроксид железа (II)
реагирует с:
|
|
а) соляной кислотой
|
б) концентрированным раствором щелочи
|
в) кислородом во влажном воздухе
|
г) разбавленной серной кислотой
|
9.
При обычных условиях как железо, так и алюминий не
реагируют с:
|
|
а) соляной кислотой
|
б) сульфатом меди (II) (р-р)
|
в) все ответы верны
|
г) азотной концентрированной кислотой
|
10.
Различить
между собой пробирки, содержащие водные растворы FeCl2 и FeCl3
можно с помощью:
|
|
а) лакмуса
|
б) нитрата серебра (I)
|
в) серной кислоты
|
г) гидроксида натрия
|
Ответы:
1
|
в
|
2
|
б
|
3
|
б
|
4
|
в
|
5
|
в
|
6
|
б
|
7
|
а
|
8
|
в
|
9
|
г
|
10
|
г
|








Комментариев нет:
Отправить комментарий