Раздел 11. Азотсодержащие органические соединения
11.1.
Амины. Аминокислоты
Амины – азотсодержащие органические
вещества, производные аммиака (NH3), в молекулах которых один или
несколько атомов водорода замещены на углеводородный радикал (- R или
– CnH2n+1)
Функциональная группа: - NH2 аминогруппа
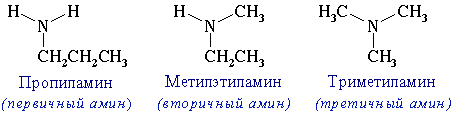
Классификация аминов:
Нахождение аминов в
природе
Амины широко
распространены в природе, так как образуются при гниении живых организмов.
Например, с триметиламином вы встречались неоднократно. Запах селедочного
рассола обусловлен именно этим веществом. Обиходное словосочетание “трупный
яд”, встречающиеся в художественной литературе, связано с аминами.
Номенклатура аминов
1. В
большинстве случаев названия аминов образуют из названий углеводородных
радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные
радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии
одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
2. Первичные
амины часто называют как производные углеводородов, в молекулах которых один
или несколько атомов водорода замещены на аминогруппы -NH2. В этом
случае аминогруппа указывается в названии суффиксами амин (одна
группа -NH2), диамин (две группы -NH2)
и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной
цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
Изомерия аминов
Структурная изомерия
- углеродного
скелета, начиная с
С4H9NH2:
- положения
аминогруппы, начиная с
С3H7NH2:
- изомерия
аминогруппы, связанная
с изменением степени замещенности атомов водорода при азоте, т.е. между типами
аминов:
Пространственная изомерия
Возможна
оптическая изомерия, начиная с С4H9NH2:
Получение аминов
Из-за запаха
низшие амины долгое время принимали за аммиак, пока в 1849 году французский
химик Шарль Вюрц не выяснил, что в отличие от аммиака, они
горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин
и этиламин.
1842
г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
Восстановление
нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 +
2H2O
или
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина)
Другие
способы:
1).
Промышленный
CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br
2).
Лабораторный - Действие щелочей на соли алкиламмония
(получение
первичных, вторичных, третичных аминов):
[R-NH3]Г + NaOH t → R-NH2 + NaГ + H2O
3). Действием
галогеналканов на первичные алифатические и ароматические аминыполучают
вторичные и третичные амины, в том числе, смешанные.
Физические свойства аминов
Метиламин,
диметиламин и триметиламин — газы, средние члены алифатического ряда -
жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный»
запах, высшие не имеют запаха.
Связь N–H
является полярной, поэтому первичные и вторичные амины образуют межмолекулярные
водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
Это
объясняет относительно высокую температуру кипения аминов по сравнению с
неполярными соединениями со сходной молекулярной массой. Например:
Третичные
амины не образуют ассоциирующих водородных связей (отсутствует группа N–H).
Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных
аминов (триэтиламин кипит при 89 °С, а н-гексиламин – при
133 °С).
По сравнению
со спиртами алифатические амины имеют более низкие температуры кипения
(т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С).
Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем
спирты, поскольку прочность водородных связей с атомом азота меньше, чем с
участием более электроотрицательного кислорода.
При обычной
температуре только низшие алифатические амины CH3NH2, (CH3)2NH
и (CH3)3N – газы (с запахом аммиака), средние гомологи –
жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины
способны к образованию водородных связей с водой:
Поэтому
низшие амины хорошо растворимы в воде. С увеличением числа и размеров
углеводородных радикалов растворимость аминов в воде уменьшается, т.к.
увеличиваются пространственные препятствия образованию водородных связей.
Ароматические амины в воде практически не растворяются.
Анилин (фениламин)
С6H5NH2 – важнейший из ароматических аминов:
Анилин
представляет собой бесцветную маслянистую жидкость с характерным запахом
(т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро
окисляется и приобретает красно-бурую окраску. Ядовит.
Свойства аминов
I. Основные свойства
Для аминов
характерны основные свойства, которые обусловлены наличием не поделённой
электронной пары на атоме азота
Алифатические
амины –
более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают
электронную плотность на атоме азота за счет +I-эффекта. По этой причине
электронная пара атома азота удерживается менее прочно и легче взаимодействует
с протоном.
Ароматические
амины являются
более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара
атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его
π-электронами.
Ряд
увеличения основных свойств аминов:
C6H5-NH2 <
NH3 < R3N < R-NH2 <
R2NH
-------------------------------------------------→
возрастание
основных свойств
|
В растворах
оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже
первичных аминов, так как три радикала создают пространственные препятствия для
сольватации образующихся аммониевых ионов. По этой же причине основность
первичных и вторичных аминов снижается с увеличением размеров и разветвленности
радикалов.
Водные
растворы аминов имеют щелочную реакцию (амины реагируют с водой по
донорно-акцепторному механизму):
R-NH2 + H2O → [R-NH3]+ +
OH-
ион алкиламмония
Анилин с водой не реагирует и не изменяет окраску
индикатора!!!
Взаимодействие
с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль - гидросульфат метиламмония)
2CH3-NH2 + H2SO4 →
[CH3-NH3]2SO4
(соль -
сульфат метиламмония)
Соли
неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 +
2NaOH → 2CH3-NH2 ↑
+ Na2SO4 + H2O
Способность к образованию растворимых солей с последующим их
разложением под действием оснований часто используют для выделения и очистки
аминов, не растворимых в воде. Например, анилин, который практически не
растворяется в воде, можно растворить в соляной кислоте и отделить
нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного
раствора), выделить анилин в свободном состоянии.
II. Реакции окисления
Реакция горения (полного окисления) аминов на
примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в
чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление
ароматических аминов используется в производстве красителей. Эти реакции обычно
очень сложны.
III. Особые свойства анилина
Для анилина
характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности
этих реакций обусловлены взаимным влиянием атомов.
1). Для анилина характерны свойства
бензольного кольца – действие аминогруппы на бензольное кольцо
приводит к увеличению подвижности водорода в кольце в орто- и пара- положениях:
С одной
стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению
алифатическими аминами и даже с аммиаком.
С другой
стороны, под влиянием аминогруппы бензольное кольцо становится более активным в
реакциях замещения, чем бензол.
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:
2). Свойства
аминогруппы:
С6Н5NН2 +
HCl → [С6Н5NН3 ]+Сl-
хлорид
фениламмония
Применение
Амины используют при получении
лекарственных веществ, красителей и исходных продуктов для органического
синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает
полиамидные волокна.
Анилин находит широкое применение в
качестве полупродукта в производстве красителей, взрывчатых веществ и
лекарственных средств (сульфаниламидные препараты).
Аминокислоты, их строение, изомерия и свойства
Среди
азотсодержащих органических веществ имеются соединения с двойственной
функцией. Особенно важными из них являются аминокислоты.
В клетках и тканях живых организмов встречается около 300 различных
аминокислот, но только 20 (α-аминокислоты) из них служат звеньями
(мономерами), из которых построены пептиды и белки всех организмов (поэтому
их называют белковыми аминокислотами). Последовательность расположения этих
аминокислот в белках закодирована в последовательности нуклеотидов
соответствующих генов. Остальные аминокислоты встречаются как в виде
свободных молекул, так и в связанном виде. Многие из аминокислот встречаются
лишь в определенных организмах, а есть и такие, которые обнаруживаются только
в одном из великого множества описанных организмов. Большинство
микроорганизмов и растения синтезируют необходимые им аминокислоты; животные
и человек не способны к образованию так называемых незаменимых аминокислот,
получаемых с пищей. Аминокислоты участвуют в обмене белков и углеводов, в
образовании важных для организмов соединений (например, пуриновых и
пиримидиновых оснований, являющихся неотъемлемой частью нуклеиновых кислот),
входят в состав гормонов, витаминов, алкалоидов, пигментов, токсинов,
антибиотиков и т. д.; некоторые аминокислоты служат посредниками при передаче
нервных импульсов.
Аминокислоты — органические амфотерные соединения, в состав
которых входят карбоксильные группы – СООН и аминогруппы -NH2.
Аминокислоты можно рассматривать как
карбоновые кислоты, в молекулах которых атом водорода в радикале замещен
аминогруппой.
КЛАССИФИКАЦИЯ
Аминокислоты классифицируют по
структурным признакам.
1. В
зависимости от взаимного расположения амино- и карбоксильной групп
аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
2. В
зависимости от количества функциональных групп различают кислые, нейтральные
и основные.
3. По
характеру углеводородного радикала различают алифатические (жирные),
ароматические, серосодержащие и гетероциклические аминокислоты.
Приведенные выше аминокислоты относятся к жирному ряду.
Примером ароматической аминокислоты может служить пара-аминобензойная
кислота:
Примером гетероциклической аминокислоты может
служить триптофан – незаменимая α-
аминокислот.
НОМЕНКЛАТУРА
По
систематической номенклатуре названия аминокислот образуются из названий
соответствующих кислот прибавлением приставки амино- и указанием
места расположения аминогруппы по отношению к карбоксильной группе. Нумерация
углеродной цепи с атома углерода карбоксильной группы.
Например:
Часто
используется также другой способ построения названий аминокислот, согласно
которому к тривиальному названию карбоновой кислоты добавляется
приставка амино- с указанием положения аминогруппы буквой
греческого алфавита.
Пример:
Для
α-аминокислот R-CH(NH2)COOH
, которые
играют исключительно важную роль в процессах жизнедеятельности животных и
растений, применяются тривиальные названия.
Если в молекуле аминокислоты
содержится две аминогруппы, то в ее названии используется приставка диамино-,
три группы NH2 – триамино- и т.д.
Пример:
Наличие двух или трех
карбоксильных групп отражается в названии суффиксом –диоваяили -триовая
кислота:
ИЗОМЕРИЯ
1. Изомерия углеродного скелета
2. Изомерия положения функциональных
групп
3. Оптическая изомерия
α-аминокислоты,
кроме глицина NН2-CH2-COOH.
ФИЗИЧЕСКИЕ СВОЙСТВА
Аминокислоты
представляют собой кристаллические вещества с высокими (выше 250°С)
температурами плавления, которые мало отличаются у индивидуальных аминокислот
и поэтому нехарактерны. Плавление сопровождается разложением вещества.
Аминокислоты хорошо растворимы в воде и нерастворимы в органических
растворителях, чем они похожи на неорганические соединения. Многие
аминокислоты обладают сладким вкусом.
ПОЛУЧЕНИЕ
3.
Микробиологический синтез. Известны микроорганизмы, которые в процессе
жизнедеятельности продуцируют α - аминокислоты белков.
ХИМИЧЕСКИЕ СВОЙСТВА
Аминокислоты
амфотерные органические соединения, для них характерны кислотно-основные
свойства.
I. Общие
свойства
1.
Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные
растворы электропроводны. Эти свойства объясняются тем, что молекулы
аминокислот существуют в виде внутренних солей, которые образуются за счет
переноса протона от карбоксила к аминогруппе:
цвиттер-ион
Водные растворы аминокислот имеют
нейтральную, кислую или щелочную среду в зависимости от количества
функциональных групп.
2. Поликонденсация → образуются полипептиды (белки):
При взаимодействии двух
α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства
карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa
- натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р.
этерификации): NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир
2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет
внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой
кислоты, в результате которого образуется ε-капролактам (полупродукт для
получения капрона):
III. Свойства
аминогруппы (основность)
1. С сильными
кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой
кислотой (подобно
первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+
H2O
гидроксокислота
Измерение
объёма выделившегося азота позволяет определить количество аминокислоты
(метод Ван-Слайка)
IV. Качественная
реакция
1. Все аминокислоты окисляются нингидрином с образованием продуктов
сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты образуют
внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю
окраску, используются для обнаружения α-аминокислот.
ПРИМЕНЕНИЕ
1) аминокислоты
широко распространены в природе;
2) молекулы
аминокислот – это те кирпичики, из которых построены все растительные и
животные белки; аминокислоты, необходимые для построения белков организма,
человек и животные получают в составе белков пищи;
3) аминокислоты
прописываются при сильном истощении, после тяжелых операций;
4) их
используют для питания больных;
5) аминокислоты
необходимы в качестве лечебного средства при некоторых болезнях (например,
глутаминовая кислота используется при нервных заболеваниях, гистидин – при
язве желудка);
6) некоторые
аминокислоты применяются в сельском хозяйстве для подкормки животных, что
положительно влияет на их рост;
7) имеют
техническое значение: аминокапроновая и аминоэнантовая кислоты образуют
синтетические волокна – капрон и энант.
|
УПРАЖНЕНИЯ
1.
При
сгорании первичного амина выделилось 2,688 л (н.у.) углекислого газа, 2,97 г
воды и 0,336 л (н.у.) азота. Установите молекулярную формулу амина.
Решение:
1) Записывается общая формула амина: Сх Нy Nz.
2) Вычисляются количества вещества углекислого газа,
воды и азота, а также соответствующие им количества вещества атомов углерода,
водорода и азота.
n (СО2) = V(СО2) / Vм = 2,688 (л)/ 22,4 (л / моль)= 0,12
моль;
n (С) = n (СО2)= 0,12 моль.
n (Н2 О)=
m (Н2 О) / М (Н2 О) = 2,97 (г) / 18 (г/ моль) =
0, 165 моль;
n (Н)= 2 n (Н2 О)=
0,33 моль.
n (N2)= V(N2) / Vм=
0,336 (л) / 22,4 (л / моль)= 0, 015 моль;
n (N)= 2 n (N2) = 0,03.
3) Определяется молекулярная формула амина.
х : у : z = 0,12 : 0,33 : 0,03 = 4 : 11 : 1.
Простейшая формула амина – С4 Н11 N.
Поскольку амин первичный (по условию), в его молекуле
содержится группа NН2, следовательно, более точно формула амина
записывается как С4 Н9 NН2
Ответ. Молекулярная формула амина. – С4 Н9 NН2
________________________________________________________________
2. При взаимодействии 3,1 г некоторого первичного
амина с достаточным количеством HBr образуется 11,2 г соли. Установите формулу
амина.
Решение:
Первичные амины (СnH2n+1NH2)
при взаимодействии с кислотами образуют соли алкиламмония:
СnH2n+1NH2 + HBr = [СnH2n+1NH3]+Br-.
К сожалению, по
массе амина и образовавшейся соли мы не сможем найти их количества (поскольку
неизвестны молярные массы). Пойдем по другому пути. Вспомним закон сохранения
массы: m(амина) + m(HBr) = m(соли), следовательно, m(HBr) = m(соли) - m(амина)
= 11,2 - 3,1 = 8,1.
Обратите внимание
на этот прием, весьма часто используемый при решении C 5. Если даже масса
реагента не дана в явной форме в условии задачи, можно попытаться найти ее по
массам других соединений.
Итак, мы вернулись
в русло стандартного алгоритма. По массе бромоводорода находим количество,
n(HBr) = n(амина), M(амина) = 31 г/моль.
Ответ: CH3NH2.
________________________________________________________________
3.
________________________________________________________________
4.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Напишите
структуры соединений по их названию: 2-аминобутан, N-метил-3-аминопентен-1;
N,N-диметил-3-амино-2-метилгексан; N,N-диметил-4-гидроксианилин.
2. Напишите
структурные формулы по названиям: ацетонимин; N-фенил-3-пентанонимин;
N-метил-ацетофенонимин.
3.
Расположите в ряд по увеличению основности следующие амины (по взаимодействию с
водой): метиламин, диметиламин, триметиламин, аммиак, гидроксиламин.
4.
Расположите в ряд по увеличению основности следующие амины (учитывая только
величину электронной плотности на атоме азота): триметиламин, аммиак,
фениламин, дифениламин.
5. С какими
из приведенных соединений будет взаимодействовать этиламин: вода, аммиак,
серная кислота, NaCl, NaOH, уксусная кислота, хлористый метил? Напишите
уравнения тех реакций, которые будут протекать.
6. Укажите,
какие из следующих аминов являются: а) первичными; б) вторичными; в) третичными. Назовите эти амины.
Массовые доли углерода, азота и водорода в
первичном амине составляют соответственно 38,7%; 45,15%
и 16,15%. Определите формулу амина и вычислите его молекулярную массу.
8. При восстановлении 92,25 г нитробензола
получили 66 г анилина по реакции Зинина. Каков выход (в %) продукта реакции.
9. Сколько
литров 10%-го раствора NaOH (p = 1,1 кг/л) потребуется для нейтрализации аминоуксусной кислоты,
полученной из карбида кальция массой 320 кг.
10. Найдите
химическое количество анилина, которое можно получить из 15 г нитробензола
(10% примесей), если массовая доля
выхода продукта реакции составляет 0,76.
|
1.
Укажите число сигма-связей в молекуле метиламина:
|
|
|
а) 6
|
б) 5
|
|
в) 7
|
г) 4
|
|
2.
Каким реагентом надо подействовать на
нитросоединение, чтобы превратить его в амин:
|
|
|
а)
кислородом
|
б) бромной водой
|
|
в) водородом
|
г) хлороводородом
|
|
3.
В каком ряду амины перечислены в порядке
возрастания основных свойств:
|
|
|
а) анилин, диэтиламин, этиламин
|
б) этиламин, анилин, диэтиламин
|
|
в) анилин, этиламин, диэтиламин
|
г) диэтиламин, этиламин, анилин
|
|
4.
Укажите число изомерных аминов состава С3Н9N:
|
|
|
а) 2
|
б) 3
|
|
в) 4
|
г) изомеров нет
|
|
5.
Сколько первичных аминов отвечает составу С3Н9N:
|
|
|
а) 2
|
б)3
|
|
в) 1
|
г) 4
|
|
6.
Состав аминов, являющихся производными алканов,
можно выразить общей формулой:
|
|
|
а) CnH2n+1NO2
|
б) CnH2n+3N
|
|
в) CnH2nNH2
|
г) CnH2n-1N
|
|
7.
Анилин можно обнаружить с помощью:
|
|
|
а) натрия
|
б) гидроксида натрия
|
|
в) бромной воды
|
г) гидрокарбоната натрия
|
|
8.
Укажите формулу вещества с наиболее выраженными
основными свойствами:
|
|
|
а) CH3NH2
|
б) NH3
|
|
в) C6H5 – NH2
|
г) (CH3)2 NH
|
|
9.
Самым слабым основанием из перечисленных является:
|
|
|
а) метиламин
|
б) диметиламин
|
|
в) фениламин
|
г)дифениламин
|
|
10.
С помощью какого реагента можно
различить анилин и бензол:
|
|
|
а) NaOH
|
б) Cu(OH)2
|
|
в) бромная вода
|
г)аммиак
|
Ответы:
|
1
|
а
|
|
2
|
в
|
|
3
|
в
|
|
4
|
в
|
|
5
|
а
|
|
6
|
б
|
|
7
|
в
|
|
8
|
г
|
|
9
|
г
|
|
10
|
в
|















































Комментариев нет:
Отправить комментарий