10.7.
Углеводы
Углеводы – соединения общей формулы Сn(H2O)n,
от которой и получили свое название – представляют собой многоатомные
альдегидоспирты или кетоспирты. Минимальная структурная единица углеводов, при
дроблении которой исчезают свойства сахаров, называется моносахаридом или монозой.
Самый простой сахар – глицериновый альдегид, имеющий строение НО-СН2-СН(ОН)-СНО.
Его брутто-формула отвечает составу С3(Н2О)3.
Классификация
углеводов
Углеводы (природные и синтетические) составляют
обширную группу соединений, которая делится на мономеры (моносахариды) и
продукты их конденсации –полисахариды. Моносахариды и полисахариды
отличаются отношением к гидролизу.
Под термином «моносахариды» понимают
полиоксикарбонильные соединения с непрерывной углерод-углеродной цепью. Они не
гидролизуются с образованием более простых сахаров. Полисахаридами называют
высокомолекулярные углеводы, при гидролизе которых получаются сотни и тысячи
молекул моносахаридов. Молекулы моносахаридов в полисахариде связаны между
собой гликозидными связями.
Моносахариды
Моносахариды разнообразны по своему строению и
свойствам, но обладают рядом общих признаков в химическом поведении. С
моносахаридами генетически связаны многоатомные спирты, полиоксикарбоновые
кислоты, дезоксисахара и аминосахара.
Простые моносахариды обычно классифицируют по
строению:
- по наличию альдегидной или кетонной группы
моносахариды делят на альдозы и кетозы;
- по числу углеродных атомов, входящих в состав
моносахарида, различают триозы, тетрозы, пентозы, гексозы и
т.д.
- комбинированная номенклатура – по числу атомов
углерода и характеру функциональной группы – альдогексозы (в
том числе глюкоза), кетогексозы (в том числе фруктоза), кетопентозы (в
том числе рибулоза) и т.д. Комбинированная номенклатура наиболее употребительна,
поскольку наиболее полно отражает характер соединения.
Оптические свойства
Соединения, имеющие атом углерода, связанный с 4
разными заместителями, могут обладать пространственными изомерами и,
соответственно, оптическими изомерами.
Наличие центров асимметрии в молекуле вызывает
появление у нее оптических свойств, которые проявляются в способности растворов
таких соединений поворачивать плоскость пропускаемого через них поляризованного
света на определенный угол – влево или вправо.
Примечание. Обычные источники света дают
неполяризованный свет, представляющий собой электромагнитное излучение, волны
которого распространяются во всех плоскостях. Для получения плоско поляризованного
света его пропускают через специальные поляризационные фильтры, «вырезающие»
электромагнитную волну, распространяющуюся только в одной плоскости.
Все моносахариды имеют атомы углерода, связанные с 4
разными заместителями (и чаще всего – не один, а несколько таких атомов,
называемых центрами асимметрии или хиральными центрами).
В качестве примера простейшего углевода, имеющего
такой атом углерода, рассмотрим молекулу глицеринового альдегида.
Если представить себе пространственную модель молекулы
глицеринового альдегида, вписанную в тетраэдр, в центре которого располагается
асимметричный атом углерода, а по вершинам направлены заместители при нем, то
получится примерно такая картина:
При наличии асимметрического (хирального) центра, у
молекулы могут существовать два пространственно несовместимых зеркальных изомера
(как несовместимы правая и левая рука). Для упрощения изображения таких
изомеров на бумаге Фишером были разработаны правила написания
проекций. Согласно этим правилам располагаем тетраэдрическую модель перед
наблюдателем так, чтобы линия, представляющая собой главную углеродную цепь
молекулы оказалась по вертикали, на вершине которой должна располагаться
старшая группировка (в нашем случае – карбонильная группа). Связи от
асимметрического углерода к этим группам должны быть направлены «к наблюдателю».
Соответственно, на горизонтальной линии оказываются
расположенными другие два заместителя, связи к которым от атома углерода
«уходят» от наблюдателя. Если при таком рассмотрении старшая из групп на
горизонтальной линии окажется справа от главной (вертикальной) цепи, изомеру
присваивается буква D, если слева от вертикальной линии – буква L. Отнесение к
D- или L-ряду моносахаридов, имеющих более одного центра асимметрии,
осуществляется по конфигурации (расположению гидроксильной группы) у
асимметрического углерода с максимальным номером.
Подавляющее большинство природных моносахаридов
принадлежит к D-ряду. Живые организмы не умеют перерабатывать L-глюкозу.
Дрожжевые клетки вырабатывают спирт только из D-глюкозы. В растениях
встречается L-арабиноза (альдопентоза), а D-арабиноза обнаружена в некоторых
видах бактерий.
Показанные на рисунке здесь и далее на этой странице
структуры углеводов изображены в проекционных формулах Фишера.
Цепь атомов углеродного остова в таких проекциях
изображается как прямая вертикальная линия, сверху которой обозначена старшая
функциональная группа (начало нумерации цепи по номенклатуре ИЮПАК). При
горизонтальных линиях изображены конформации у асимметрических углеродных
центров (сами атомы углерода не показаны, они располагаются «в перекрестиях»).
Атомы водорода при асимметрических центрах также не всегда показаны.
У глицеринового альдегида имеется один центр
асимметрии, углерод под номером 2, у пятиатомных углеводов
(альдопентоз) – три центра асимметрии (углероды 2, 3 и 4),
у альдогексоз – 4 центра (углероды 2, 3, 4, 5).
Наличие центров асимметрии одновременно означает
наличие изомеров углеводов, число этих изомеров определяется числом центров
асимметрии и связано выражением:число изомеров (N) = 2n, где n – число центров асимметрии.
Существует восемь
D-изомеров альдогексоз. Сравните их строение с кетогексозой (D-фруктозой) и структурой L-изомера
глюкозы.
Таким образом, 16 теоретически возможных изомеров
альдогексоз (4 центра асимметрии) представлены восемью парами (D- и L-)
энантиомеров.
Классификация изомеров
моноз
Энантиомерами называются зеркально
симметричные изомеры, конфигурации у асимметрических центров которых
зеркально противоположны. Так, энантиомерами являются D-глюкоза и L-глюкоза.
Другая примерная пара энантиомеров: D-рибоза и L-рибоза. Образно говоря, энантиомеры
отличаются друг от друга как левая и правая рука, которые несовместимы в
пространстве.
Эпимерами называют изомеры, различающиеся конфигурацией только
при одном из центров асимметрии. Эпимерами являются пары
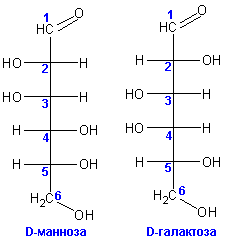
D-глюкоза и D-манноза (различная конфигурация при атоме углерода 2), а также
D-глюкоза и D-галактоза (различная конфигурация при атоме углерода 4).
Изомеры, у которых конфигурация различается более чем
при одном центре асимметрии, называют диастереомерами (иногда
их называют диастереоизомерами). Примером является пара D-манноза и
D-галактоза:
Рацемической смесью называют эквимолярную (состоящую
из одинакового числа молекул D- и L-ряда) смесь энантиомеров, не обладающую
оптической активностью. На самом деле оптическая активность отдельных молекул
никуда не делась, просто происходит взаимная компенсация «вращений» плоскости
света, отчего создается иллюзия отсутствия вращения. Дело в том, что D- и
L-изомеры вращают плоскость поляризации в разных направлениях, но
на одинаковые углы.
Соединение молекул моносахаридов приводит к
образованию дисахаридов, трисахаридов, тетрасахаридов и т.д. Полисахариды с
числом мономерных звеньев углеводов до 8 называют олигосахаридами, а более –
полисахаридами. В результате гидролиза олиго- и полисахаридов образуются ди- и
моносахариды.
Циклические формы
углеводов (моносахаридов)
Более распространенной формой нахождения углеводов в
природе является не цепная, а циклическая. В свое время исследователи обратили
внимание на такое явление: при растворении D-изомера глюкозы в воде происходило
постепенное изменение первоначального угла вращения плоскости поляризованного
света со значения +112° до некоторого равновесного значения в +53,8°.
Равновесие устанавливалось быстрее, если раствор имел кислую или щелочную реакцию.
Оказалось, что причиной этого является
взаимопревращение форм глюкозы друг в друга (различных циклических в линейные и
наоборот), называемое мутаротацией:
В основе этого явления лежат химические превращения,
сутью которых является образование циклических внутримолекулярных полуацеталей,
когда карбонильная группа взаимодействует с гидроксилом внутри одной молекулы.
В случае глюкозы, при взаимодействии карбонильной группы с 5-м гидроксилом
получаются шестичленные циклы, а при взаимодействии с 4-м гидроксилом –
пятичленные. Шестичленные циклы, по аналогии с органическим соединением пиран,
имеющим такое же строение цикла, называютпиранозными циклами, а
пятичленные циклы – фуранозными (по аналогии с молекулой фурана).
Пиран и фуран имеют следующее строение:
В результате циклизации происходит образование
дополнительного (к 4 имевшимся) центра асимметрии в молекуле. Им становится
атом углерода под номером 1. Соответственно, появляется
дополнительная пара изомеров, называемая аномерами. Гидроксильная
группа при этом атоме углерода называется аномерной, или гликозидной,и
ее расположение в пространстве определяет вид аномера. Если она расположена
вверх от кольца – это будет β-аномер, если вниз – α-аномер.
Циклические формы D-изомеров при этом имеют группировку СН2ОН (шестой
атом углерода гексоз), расположенную также вверх от плоскости кольца (у
L-изомеров – вниз от плоскости кольца). Используемые здесь и далее способы изображения
моносахаридов в виде циклических структур были разработаны Хеуорсом (Haworth)
и являются наиболее распространенными в настоящее время (в отличие от неудобных
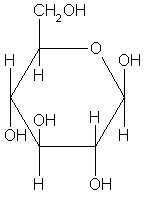
структур Фишера). Циклические формы D-глюкозы показаны ниже:
Общее число изомеров альдогексоз в циклической форме
возрастает до 64 (против 16 изомеров у
линейной формы), которые включают по 32 пиранозные и фуранозныеформы
(5 центров асимметрии у каждой).
В циклических формах существуют и другие моносахариды.
Например, фруктоза:
Рибоза:
А также уже известные нам манноза и галактоза:
Аномерный (гликозидный, полуацетальный) гидроксил в
циклических молекулах моносахаридов обладает особыми свойствами, отличающимися
от свойств остальных четырех гидроксильных групп. Так, в кислой среде он легко
образует простые эфиры со спиртами (вообще любыми соединениями, имеющими
гидроксильную группу), в результате образования полного ацеталя.
Полученные соединения углеводов со спиртами называют гликозидами (отсюда
и название – гликозидный гидроксил). Остальные гидроксилы образуют
простые и сложные эфиры только в условиях, характерных для обычных спиртов.
После образования гликозида циклическая форма углевода теряет способность к
раскрытию кольца и перестает обнаруживать восстановительные свойства, присущие
только открытой цепи альдоз.
Существование особого гидроксила является предпосылкой
к образованию полимеров из моносахаридных звеньев.
Распространение в природе
Будучи чрезвычайно реакционноспособными соединениями,
моносахариды редко встречаются в свободном виде. В живых организмах углеводы
существуют в виде производных – эфиров фосфорной кислоты, либо в виде
гликозидов и полисахаридов, гликопротеинов, нуклеиновых кислот. Наиболее широко
в природе распространены пентозы и гексозы. Общеизвестный представитель гексоз
– глюкоза, содержащаяся в растительных соках, плодах, фруктах и особенно в
винограде. Глюкоза – обязательный компонент крови и тканей животных и является
источником энергии для клеточных реакций. Пополнение содержания глюкозы в крови
происходит за счет резервных углеводов, например, гликогена в печени и мышцах.
Источником углеводов для живых организмов является фотосинтез, осуществляемый
растениями. Животные организмы получают моносахариды из растительных
источников, а затем используют их для синтеза полисахаридов либо для получения
энергии в результате метаболизма.
Глюкоза входит в состав различных соединений, начиная
с дисахаридов (сахароза и мальтоза), полисахаридов (крахмал, гликоген, целлюлоза)
и заканчивая гликопротеинами и гликозидами различного происхождения и строения,
многие из которых используются как лечебные препараты. Специфическую
биологическую функцию выполняют D-рибоза и 2-дезокси-D-рибоза, которые входят в
состав полимерной цепи ДНК и РНК.
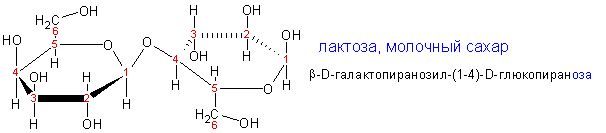
Дисахариды
Дисахариды являются ацетальными формами углеводов,
когда одно из колец присоединяет второе кольцо моносахарида в результате
образования гликозидной связи с одним из 5 (у гексоз) гидроксилов второго
кольца. Наиболее распространены следующие дисахариды.
Восстанавливающие:
Невосстанавливающие:
Почему сахароза и трегалоза являются
невосстанавливающими дисахаридами? У сахарозы единственный гликозидный
гидроксил (в кольце глюкозы) оказался связанным гликозидной связью с кольцом
фруктозы. Поэтому стало невозможным раскрытие кольца, а следовательно, и
наличие восстанавливающих свойств. В молекуле трегалозы оба гликозидных
гидроксила оказались связанными (друг с другом) с теми же последствиями.
Дисахариды широко распространены в природе.
Значительные количества дисахаридов накапливаются в клетках некоторых растений
(сахарный тростник и сахарная свекла содержат очень много сахарозы).
Значительно реже встречаются трисахариды,
практически не встречаются олигосахариды, содержащие от 4 до 10 и
более остатков моносахаридных звеньев в молекуле. Олигосахаридами богаты только
продукты искусственного гидролиза полисахаридов, такие как патока.
Полисахариды
Для характеристики полисахаридов важно знать, из каких
остатков моносахаридов построена цепь, каким образом они связаны между собой и
чем отличается их макроструктура.
Классификация полисахаридов
Существует несколько видов классификации:
- по типу моносахаридов, входящих в полисахарид;
- по источникам выделения полисахаридов;
- по функциональному назначению.
По
типу моносахаридов различают гомополисахариды и гетерополисахариды. Гомополисахариды построены
из остатков моносахаридов одного типа (амилоза, амилопектин, гликоген,
целлюлоза, пектин). Так, построенные из молекул глюкозы полимеры называют глюканами,
иногда конкретизируя особенности строения цепи (тип гликозидной связи и номера
гидроксильных групп, через которые образованы связи). Например, линейную
амилозу называют α-D-(1-4)глюкан, а целлюлозу – β-D-(1-4)глюкан.
Гетерополисахариды содержат остатки двух или большего
числа моносахаридов, для которых важна последовательность чередования в
молекуле полимера (гиалуроновая кислота, альгиновая кислота,
арабиноглюкогалактаны, хондроитинсульфаты, гепарин и др.).
По источникам выделения полисахариды делятся
на три группы:
- фитосахариды (инулин, пектин,
целлюлоза, амилоза, амилопектин, ламинарин и т.д.);
- полисахариды микроорганизмов (мананниты
и др.);
- зоополисахариды (гликоген, хитин,
хондроитинсульфаты, гепарин и т.д.).
С точки зрения функционального назначения полисахариды
делятся на структурные, резервные и полисахариды с иными функциями. Важнейшими
структурными полисахаридами являются целлюлоза (растения), хитин (насекомые),
гиалуроновая кислота и хондроитинсульфаты (животные). Главными резервными
полисахаридами являются крахмал (амилопектин + амилоза) и гликоген.
Полисахариды с иными функциями – камеди, слизи и др.
Строение полисахаридов
Наиболее важными из гомополисахаридов являются
амилоза, амилопектин, целлюлоза и гликоген (глюканы), состоящие из остатков
глюкозы. Полисахарид инулин построен из остатков фруктозы (полифруктозан),
названия других полисахаридов прямо указывают на остатки углеводов, из которых
те построены – маннан, галактан, арабан. Важнейшей характеристикой полисахаридов
является их вторичная структура – пространственная организация молекулы.
Крахмал – резервный полисахарид растений. В пшенице его
57 %, в кукурузе – 65–72 %, в рисе – 62–85 %. Крахмал
представляет из себя сложную смесь из полисахаридов, содержащую незначительные
количества золы, белка, жиров. Главными компонентами крахмала являются линейный
полисахарид амилоза (на ее долю приходится от 100 % во фруктах до 0 %
в некоторых сортах кукурузы, в среднем 20–25 % в других растениях) и разветвленный
полисахарид амилопектин (обычное содержание 75–80 % в различных сортах
растений).
1. Физические
свойства
Это белый порошок, нерастворимый в
холодной воде и образующий коллоидный раствор (крахмальный клейстер) в
горячей воде. Существует в двух формах: амилоза – линейный полимер,
растворимый в горячей воде, амилопектин – разветвлённый полимер, не
растворимый в воде, лишь набухает.
2. Нахождение в природе
Крахмал – основной источник
резервной энергии в растительных клетках – образуется в растениях в процессе
фотосинтеза и накапливается в клубнях, корнях, семенах:
6CO2 + 6H2O свет,
хлорофилл → C6H12O6 + 6O2
nC6H12O6 → (C6H10O5)n + nH2O
глюкоза
крахмал
Содержится в клубнях картофеля,
зёрнах пшеницы, риса, кукурузы.
Гликоген (животный крахмал),
образуется в печени и мышцах животных.
3. Строение
Состоит из остатков α -
глюкозы.
В
состав крахмала входят:
· амилоза
(внутренняя часть крахмального зерна) – 10-20%
· амилопектин
(оболочка крахмального зерна) – 80-90%
Цепь амилозы включает
200 – 1000 остатков α-глюкозы и имеет неразветвленное строение.
Амилопектин состоит из разветвленных
макромолекул, молекулярная масса которых достигает 1 - 6 млн.
Амилоза
и амилопектин гидролизуются под действием кислот или ферментов до глюкозы,
которая служит непосредственным источником энергии для клеточных реакций,
входит в состав крови и тканей, участвует в обменных процессах. Поэтому
крахмал – необходимый резервный углевод питания.
Подобно
амилопектину построен гликоген (животный крахмал),
макромолекулы которого отличаются большей разветвлённостью:
4. Применение
Крахмал широко применяется в
различных отраслях промышленности (пищевой, бродильной, фармацевтической,
текстильной, бумажной и т.п.).
· Ценный
питательный продукт.
· Для
накрахмаливания белья.
· В
качестве декстринового клея.
5. Химические свойства
полисахаридов
Гидролиз:
(C6H10O5)n + nH2O t,H2SO4 → nC6H12O6
глюкоза
Гидролиз протекает ступенчато:
(C6H10O5)n → (C6H10O5)m → xC12H22O11 → n C6H12O6 (Примечание, m<n)
крахмал
декстрины мальтоза глюкоза
Качественная реакция:
Охлаждённый
крахмальный клейстер + I2 (раствор) = синее
окрашивание, которое исчезает при нагревании.
Макромолекула
амилозы представляет собой спираль, каждый виток которой состоит из 6 звеньев
α-глюкозы.
При
взаимодействии амилозы с йодом в водном растворе молекулы йода входят во
внутренний канал спирали, образуя так называемое соединение включения.
Это соединение имеет характерный синий цвет. Данная реакция используется в
аналитических целях для обнаружения, как крахмала, так и йода (йодкрахмальная
проба)
|
Амилоза – линейный полисахарид (α-D-(1-4)-глюкан),
состоящий из остатков D-глюкозы, связанных α-(1-4)-гликозидными связями.
Структурной единицей амилозы является дисахарид мальтоза:
Амилопектин отличается от амилозы большей
молекулярной массой и наличием разветвлений в цепи по местам (1-6). Частота
ветвления – одно на примерно каждые 20 остатков моносахаридов. Структурными
единицами амилопектина являются мальтоза (ветвление 1a4) и изомальтоза
(ветвление 1a6):
Молекулярная масса амилопектина может достигать
20 000 000.
Различаются также и физические свойства амилозы и
амилопектина. Амилоза растворяется в горячей воде с образованием маловязких
растворов, амилопектин способен набухать в воде при температуре ее кипения с
образованием коллоидных растворов вследствие гидратации.
И амилоза, и амилопектин в желудочно-кишечном тракте
(ЖКТ) человека легко расщепляются амилазами с образованием моносахаридов –
глюкозы, поэтому являются усваиваемыми компонентами пищи и источником энергии,
в отличие от целлюлозы, которая в ЖКТ не изменяется и выполняет только функции
наполнителя, влияющего на моторику ЖКТ. При гидролизе крахмала нагреванием в
присутствии минеральных кислот в качестве промежуточных продуктов образуются
полисахариды различной молекулярной массы (декстрины), а также глюкоза, мальтоза
и изомальтоза. Декстрины дают различную окраску с йодом – от фиолетово-синей
(амилодекстрин) до красно-бурой (эритродекстрин) и без окраски (ахродекстрины и
мальтодекстрины). Различаются декстрины растворимостью в растворе этанола
разной крепости.
Целлюлоза – линейный β-(1-4)-D-глюкан,
структурной единицей которой является целлобиоза:
Линейные молекулы целлюлозы взаимодействуют друг с
другом межмолекулярно, с образованием нерастворимых в воде микрофибрилл,
образующих остов растений.
Распространенность в природе углеводов очень велика,
они составляют примерно 50 % всей массы биосферы, древесина содержит от 80
до 90 % от сухой массы целлюлозы, хлопок – чуть менее 100 %.
Гликозидные связи между мономерами в целлюлозе не
гидролизуются в организме большинства животных и человека. Поэтому целлюлоза
ими не усваивается и не может являться источником питательных веществ. Однако
они гидролизуются под воздействием фермента целлюлазы, вырабатываемой
некоторыми микроорганизмами в желудке жвачных животных, поэтому в этом случае
являются источником пищи.
Резервным полисахаридом человека и других
млекопитающих является гликоген,
локализованный преимущественно в печени (до 10 % от ее массы) и мышцах (до
4 %). Гликоген отличается от амилопектина большей частотой ветвления: 1 на
8–12 остатков моносахаридов, образует сферической формы гранулы, имеющие ММ от
300 000 до 100 млн. Гранулы гликогена настолько плотно упакованы
вследствие сильного разветвления, что не разбухают даже в кипящей воде, в
отличие от амилопектина. На срезе тканей печени сытой крысы под микроскопом
можно видеть белые гранулы гликогена.
Пектиновые вещества присутствуют в растениях в
виде нерастворимого протопектина в незрелых плодах, придающего
им жесткость. По мере созревания или хранения протопектин разрушается
протопектиназами с образованием полисахаридов арабана, галактана и
собственно пектина, представляющего собой метоксилированную
полигалактуроновую кислоту:
Именно благодаря полимерным молекулам пектина способны
к желеобразованию многие плоды и фрукты. Молекулы пектина
образуют решетку, захватывающую молекулы воды, в результате чего
происходит желирование сока. Некоторые сорта яблок содержат
настолько много пектина, что при вываривании легко образуют мармелад без
добавления желатина или агара – других видов полисахаридов.
Физико-химические
свойства углеводов
Моносахариды – твердые кристаллические вещества,
хорошо растворимые в воде, плохо растворимые в спирте и эфире. Различные
моносахариды существенно различаются степенью сладости по органолептической
оценке. Если принять условно сладость сахарозы за 100 %, то фруктоза в
таком же количестве является гораздо более сладкой – 173 %, глюкоза –
менее сладкой – 74 %, ксилоза – 40 %. Самый «несладкий» сахар – молочный – лактоза. Ее сладость
в том же количестве составляет всего 16 % от сладости сахарозы.
Концентрированные кислоты дегидратируют моносахариды
и дают в результате циклические альдегиды – фурфурали:
|
Образующиеся фурфурали могут вступать с фенолами или
их производными в реакции конденсации с образованием окрашенных продуктов, на
этом основано количественное определение моносахаридов (фенолсернокислотный
метод со спектрофотометрическим окончанием). Свободные моносахариды поглощают
в ультрафиолете очень слабо и лишь при длине волны 195 нм, т.е. в
неспецифической области. Поэтому прямое их определение спектральными методами
весьма затруднено. При нагревании с разбавленными щелочами моносахариды
вступают в реакции поликонденсации, также с образованием окрашенных продуктов
(метод количественного определения сахаров в моче по Альтгаузену).
|
Окисление сахаров. При воздействии различными
окислителями могут быть получены различные сахарные кислоты (гликаровые,
гликоновые или гликуроновые).
В виде кислот моносахаридные звенья могут встречаться
в природных полимерах (пектин).
Восстановление сахаров. В результате восстановления
моносахаридов образуются многоатомные спирты. При восстановлении глюкозы
получается сорбит, при восстановлении маннозы – маннит, а при восстановлении
фруктозы образуются сорбит и маннит одновременно.
Моносахариды встречаются в природе как в чистом виде,
так и в составе т.н. гликозидов, в результате образования связи с молекулами
практически любых органических соединений через их гидроксильную группу.
Гликозиды, таким образом, состоят из углеводного компонента (сахара) и
несахарной части, называемой агликоном. Строение гликозида салицин (2-гидроксиметил-фенил-β-D-глюкофуранозид)
показано ниже:
|
Со стороны углевода в образовании связи участвует
полуацетальный гидроксил (синонимы – гликозидный гидроксил, аномерный
гидроксил), со стороны агликона – любой гидроксил. Напоминаем, что гликозидный
гидроксил в углеводах обладает резко отличающимися от остальных гидроксильных
групп свойствами. В частности, он легко вступает в реакции образования полных
ацеталей, катализируемых кислотами.
|
Наконец, достаточно часто углеводы присутствуют (особенно
в полимерах) в виде производных с азотом, когда гидроксильная группа у второго
атома углерода заменена на аминогруппу. Практически всегда эта аминогруппа
ацетилирована:
Реакции углеводов по функциональным группам родственных соединений
(гидроксильная, карбонильная группы).
1. Метилирование
Углеводы метилируются (образуют простые эфиры) по всем
гидроксильным группам йодистым метилом в щелочной среде (КОН) с образованием
полиметилированного метилгликозида:
Однако метоксильная группа при первом атоме углерода –
гликозидная, и легко отщепляется в кислой среде:
после чего кольцо опять способно раскрываться:
2. Ацилирование
(этерификация гидроксильных групп)
Гидроксильные группы моно- и полисахаридов способны
ацилироваться. Успешнее всего реакция идет с ангидридами и хлорангидридами
кислот:
3. Окисление карбонильной
группы альдоз
Альдозы способны окисляться даже слабыми оксилителями
до гликоновых кислот (см. выше):
Кетозы не окисляются без разрушения углеродного скелета.
УПРАЖНЕНИЯ
1. С помощью каких реакций можно
осуществить следующие превращения: сахароза → глюкоза → глюконовая кислота?
Решение:
Сахароза
гидролизуется при нагревании в подкисленном растворе:
Глюкоза окисляется свежеосажденным гидроксидом меди
(II) с образованием глюконовой кислоты (С6Н12О7):
2. Полученное из глюкозы соединение С3Н6О3 в реакции с натрием образует
соединение состава C3H4Na2O3,
с карбонатом кальция — С6Н10СаО6, с этанолом в
присутствии серной кислоты — С5Н10О3. Назовите
это соединение и напишите уравнения реакций.
Решение:
При
молочнокислом брожении из глюкозы получается молочная (2-гидроксипропановая)
кислота:
С6Н12О6 → 2СН3-СН(ОН)-СООН.
В
реакции молочной кислоты с натрием участвуют и гидроксильная и карбоксильная
группы:
СН3-СН(ОН)-СООН
+ 2Na → CH3—CH(ONa)-COONa + H2↑
С
карбонатом кальция и с этанолом молочная кислота реагирует как обычная
карбоновая кислота:
СаСО3 +
2СН3СН(ОН)СООН → (СН3СН(ОН)СОО)2Са + CO2↑ + Н2О,
t, H+
СН3СН(ОН)СООН+С2Н5ОН → СН3СН(ОН)СООС2Н5+Н2О.
СН3СН(ОН)СООН+С2Н5ОН → СН3СН(ОН)СООС2Н5+Н2О.
________________________________________________________________
3. Вещество состава С6Н12О5Сl2 при гидролизе в водном растворе
образует смесь пираноз А и Б, причем фрагменты А входят в состав целлюлозы.
Напишите структурные формулы веществ А и Б, а также уравнения соответствующих
реакций.
Решение:
Фрагменты А входят в состав целлюлозы, следовательно А
— β-глюкоза (изображена в пиранозной форме, т.е. в форме
6-членного цикла):
А— β -глюкоза
Смесь линейной формы глюкозы, α-глюкозы и β-глюкозы
образуется при гидролизе следующего дихлорида:
СН2ОН-(СНОН)4-СНСl2 + Н2О → С6Н12О6 + 2HCl
(гидролиз дихлоридов — один из способов получения
альдегидов).
Вещество Б — α-глюкоза в пиранозной форме:
Б — α-глюкоза
________________________________________________________________
4. Массовая доля крахмала в картофеле
составляет 20%. Рассчитайте массу глюкозы, которая может быть получена из
картофеля массой 405 кг. Выход продукта равен 70%.
Решение:
Составляем
уравнение реакции гидролиза крахмала, в результате которой образуется глюкоза:
Рассчитаем
массу крахмала в картофеле:
Определяем
количество вещества крахмала:
Из
уравнения реакции гидролиза крахмала следует
откуда
получаем
n(глюкозы) = x∙n (крахмала);
Вычисляем
массу глюкозы, которую можно получить при количественном выходе:
m(глюкозы) = n(глюкозы)М(глюкозы); m(глюкозы) = 0,5∙180 кг = 90 кг.
Учитывая
массовую долю выхода продукта, рассчитаем массу реально полученной глюкозы:
;
________________________________________________________________
5.
________________________________________________________________
6.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Сколько
атомов углерода содержат альдогексозы?
2.
Альдопентоза – это моносахарид или дисахарид?
3. Глюкоза –
это дисахарид, моносахарид, кетогексоза, восстанавливающая,
невосстанавливающая? Выберите правильные утверждения.
4. Сколько
асимметрических центров (атомов углерода) содержат альдопентозы?
5. Сколько
асимметрических центров (атомов углерода) содержат кетогексозы?
6. При
спиртовом брожении глюкозы выделилось 5,6 л углекислого газа (н.у.). Чему равна
масса глюкозы, подвергшейся брожению.
7. При
маслянокислом брожении глюкозы выделилось 11,2 л водорода (н.у.). Какая масса
глюкозы подверглась брожению.
8. В
результате кислотного гидролиза 10 г целлюлозы получили 5,2 г глюкозы. Сколько
процентов это составляет от теоретически рассчитанного количества.
9. Найдите
массу глюконовой кислоты, образовавшейся при обработке глюкозы массой 160 г
бромной водой, если известно, что выход кислоты в реакции оказался равен 85 %.
10. Определите
массу глюкозы, содержащей 2 % примесей, которая была подвергнута спиртовому
брожению, если при этом выделилось столько же углекислого газа, сколько его
образуется при полном сгорании 18,4 г этанола (н.у.).
|
1.
Нециклическая форма глюкозы не может вступать в реакцию:
|
|
|
а) этерификации
|
б) гидрирования
|
|
в) гидролиза
|
г) окисления
|
|
2.
В какое органическое вещество превращается глюкоза
при осторожном окислении:
|
|
|
а) шестиатомный спирт
|
б) глюконовую кислоту
|
|
в) молочную кислоту
|
г) сахарозу
|
|
3.
Сколько молекул уксусной кислоты необходимо для
полной этерификации 1 моль глюкозы:
|
|
|
а) 1
|
б) 5
|
|
в) 3
|
г) 4
|
|
4.
Какая функциональная группа присутствует в
циклической форме глюкозы:
|
|
|
а) гидроксильная
|
б) альдегидная
|
|
в) карбоксильная
|
г) карбонильная
|
|
5.
Глюкоза
образует сложные эфиры, реагируя:
|
|
|
а) со спиртами
|
б) с гидроксидои меди (II) при комнатной температуре
|
|
в) с карбоновыми кислотами
|
г) с водородом
|
|
6.
Чтобы превратить глюкозу в шестиатомный спирт ее
нужно ввести в реакцию с:
|
|
|
а) уксусной кислотой
|
б) аммиачным раствором оксида серебра
(I)
|
|
в) этанолом
|
г) водородом
|
|
7.
В природных веществах макромолекулы крахмала и
целлюлозы образуются из отдельных молекул глюкозы за счет реакции:
|
|
|
а) этерификации
|
б) полимеризации
|
|
в) поликонденсации
|
г) окисления
|
|
8.
Продуктами гидролиза сахарозы являются:
|
|
|
а) глюкоза и мальтоза
|
б) целлюлоза и фруктоза
|
|
в) глюкоза и фруктоза
|
г) крахмал и фруктоза
|
|
9.
Что является конечным продуктом гидролиза
крахмала:
|
|
|
а) декстрины
|
б) клейстер
|
|
в) ɑ-глюкоза
|
г) мальтоза
|
|
10.
Патокой называется:
|
|
|
а) смесь целлюлозы и глюкозы
|
б) смесь декстринов и глюкозы
|
|
в) смесь декстринов и фруктозы
|
г) смесь фруктозы т глюкозы
|
Ответы:
|
1
|
в
|
|
2
|
б
|
|
3
|
б
|
|
4
|
а
|
|
5
|
в
|
|
6
|
г
|
|
7
|
в
|
|
8
|
в
|
|
9
|
в
|
|
10
|
б
|



































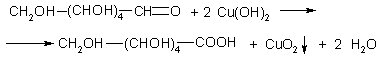












Комментариев нет:
Отправить комментарий