3.7. Химическая связь и строение вещества.
Ковалентная связь
Вещества состоят
из связанных
атомов. Силы, которые обусловливают связь между атомами, получили
название «химическая связь». По
своей природе эти силы являются электростатическими. Они представляют собой
различные виды взаимодействия электрических зарядов (электронов и ядер
взаимодействующих атомов).
Результатом
связывания атомов является образование более сложных структур – молекул,
молекулярных ионов, свободных радикалов, а также ионных, атомных и металлических кристаллических решеток.
Существование
этих структур обусловлено различными типами химической связи. Важнейшие из них:
ковалентная, ионная, металлическая,
водородная связи.
·
Ковалентная
связь
является причиной образования большинства молекул, молекулярных ионов,
свободных радикалов и атомных кристаллических решеток.
·
Ионная связь обусловливает
существование молекул ионных соединений и ионных кристаллических решеток.
·
Металлическая
связь существует
в простых веществах-металлах.
·
Водородная связь существует
внутри молекул определенных веществ, а также возникает между молекулами
некоторых веществ.
Типы
химической связи и их основные отличительные признаки
Химическая связь
|
Связываемые
атомы
|
Характер
элементов
|
Процесс
в электронной оболочке
|
Образующиеся
частицы
|
Кристаллическая
решетка
|
Характер
вещества
|
Примеры
|
Ионная
|
Атом металла и атом неметалла
|
Электрополо-
жительный и электро- отрицательный |
Переход валентных электронов
|
Положительные и отрицательные ионы
|
Ионная
|
Солеобраз-
ный |
NaCl CaO NaOH
|
Ковалентная
|
Атомы неметаллов (реже-атомы металлов)
|
Электроотрица-
тельный реже электрополо- жительный |
Образование общих электронных пар,
заполнение молекулярных орбиталей
|
Молекулы
|
Молекулярная
|
Летучий или нелетучий
|
Br2 CO2 C6H6
|
---------
|
Атомная
|
Алмазоподоб
ный |
Алмаз Si SiC
|
||||
Металличес
кая |
Атомы металлов
|
Электрополо-
жительный |
Отдача валентных электронов
|
Положительные ионы и электронный газ
|
Металлическая
|
Металличес-
кая |
Металлы и сплавы
|
Ковалентная
связь
Ковалентная связь образуется за счёт общих электронных пар, возникающих в
оболочках связываемых атомов.
Она может быть
образована атомами одного итого же элемента и тогда она неполярная; например,
такая ковалентная связь существует в молекулах одноэлементных газов H2,
O2, N2, Cl2 и др.
|
Ковалентная связь
может быть образована атомами разных элементов, сходных по химическому
характеру, и тогда она полярная; например, такая ковалентная связь существует
в молекулах H2O, NF3, CO2. Ковалентная связь
образуется между атомами элементов,
|
Необходимо ввести
понятие электроотрицательность. Электроотрицательность - это
способность атомов химического элемента оттягивать к себе общие электронные
пары, участвующие в образовании химической связи.
ряд электроотрицательностей
Относительные
электроотрицательности элементов (по Полингу)
группа
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
|||
период
|
|||||||||||
1
|
H
2,1 |
He
- |
|||||||||
2
|
Li
0,97 |
Be
1,47 |
B
2,01 |
C
2,50 |
N
3,07 |
O
3,5 |
F
4,10 |
Ne
- |
|||
3
|
Na
1,01 |
Mg
1,23 |
Al
1,47 |
Si
1,74 |
P
2,1 |
S
2,6 |
Cl
2,83 |
Ar
- |
|||
4
|
K
0,91 |
Ca
1,04 |
Sc
1,20 |
Ti
1,32 |
V
1,45 |
Cr
1,56 |
Mn
1,60 |
Fe
1,64 |
Co
1,70 |
Ni
1,75 |
|
Cu
1,75 |
Zn
1,66 |
Ga
1,82 |
Ge
2,02 |
As
2,20 |
Se
2,48 |
Br
2,74 |
Kr
- |
||||
5
|
Rb
0,89 |
Sr
0,99 |
Y
1,11 |
Zr
1,22 |
Nb
1,23 |
Mo
1,30 |
Tc
1,36 |
Ru
1,42 |
Rh
1,45 |
Pd
1,35 |
|
Ag
1,42 |
Cd
1,46 |
In
1,49 |
Sn
1,72 |
Sb
1,82 |
Te
2,01 |
I
2,21 |
Xe
- |
||||
6
|
Cs
0,86 |
Ba
0,97 |
La*
1,08 |
Hf
1,23 |
Ta
1,33 |
W
1,40 |
Re
1,46 |
Os
1,52 |
Ir
1,55 |
Pt
1,44 |
|
Au
1,42 |
Hg
1,44 |
Tl
1,44 |
Pb
1,55 |
Bi
1,67 |
Po
1,76 |
At
1,90 |
Rn
- |
||||
7
|
Fr
0,86 |
Ra
0,97 |
Ac**
1,00 |
*Лантаноиды
- 1,08 - 1,14
**Актиноиды - 1,11 - 1,20 |
|||||||
Элементы с большей электроотрицательностью будут оттягивать общие электроны
от элементов с меньшей электроотрицательностью.
Для наглядного изображения ковалентной связи в химических формулах используются точки ( каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре ).
Для наглядного изображения ковалентной связи в химических формулах используются точки ( каждая точка отвечает валентному электрону, а также черта отвечает общей электронной паре ).
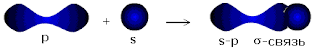
Существует несколько способов образования ковалентных связей за счёт
перекрывания электронных облаков.
σ - связь значительно прочнее π-связи, причём π-связь может быть
только с σ-связью, За счёт этой связи образуются двойные и тройные кратные
связи.
Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.
Полярные ковалентные связи образуются между атомами с разной электроотрицательностью.
За счёт смещения электронов от водорода к хлору атом хлора заряжается
частично отрицательно, водорода-частично положительно.
В
слове "ковалентная"
приставка "ко-" означает "совместное участие". А
"валента" в переводе на русский – сила, способность. В данном случае
имеется в виду способность атомов связываться с другими атомами.
При
образовании ковалентной связи атомы объединяют свои электроны как бы в общую
"копилку" – молекулярную
орбиталь, которая формируется из атомных оболочек отдельных атомов. Эта
новая оболочка содержит по возможности завершенное число электронов и заменяет атомам их
собственные незавершенные атомные оболочки.
Рассмотрим
возникновение ковалентной связи на примере образования молекулы водорода из
двух атомов водорода (рис. 3-1). Этот процесс уже является типичной химической реакцией, потому что из одного вещества
(атомарного водорода) образуется другое – молекулярный водород. Внешним
признаком энергетической выгодности этого процесса является выделение большого
количества теплоты.
Возникновение ковалентной связи при образовании молекулы водорода
из двух атомов водорода. Электронные оболочки атомов водорода (с одним
s-электроном у каждого атома) сливаются в общее электронное облако
(молекулярную орбиталь), где оба электрона "обслуживают" ядра
независимо от того, "свое" это ядро или "чужое".
Когда электронные оболочки двух атомов водорода сближаются и
образуют новую, теперь уже молекулярную электронную оболочку (рис. 3-1),
эта новая оболочка подобна завершенной электронной оболочке атома
благородного газа гелия (1s2).
Завершенные оболочки, как мы помним, устойчивее незавершенных.
Таким образом, суммарная энергия новой системы – молекулы водорода –
оказывается гораздо ниже суммарной энергии двух несвязанных атомов водорода.
Избыток энергии при этом выделяется в виде теплоты.
Минимум энергии молекулы отвечает определенному расстоянию между
ядрами атомов водорода (рис. 3-2). Если атомы в молекуле с помощью внешней силы
сдвинуть еще ближе, то в действие вступает мощное отталкивание между одноименно
заряженными ядрами атомов и общая энергия системы начинает возрастать. Это
невыгодно системе, поэтому длина связи представляет собой строго определенное,
равновесное значение. Для молекулы водорода равновесная длина химической связи
составляет 0,74 ангстрема (1 А = 10–8 см), как это видно на рис. 3-2
.
Кривая
изменения потенциальной энергии при взаимодействии двух атомов водорода с
образованием молекулы водорода
В образовавшейся системе из двух водородных атомов каждое ядро
обслуживается двумя электронами. В новой (молекулярной) оболочке уже невозможно
различить, какой из электронов ранее принадлежал тому или другому атому.
Принято говорить, что электроны обобществлены.
Поскольку оба ядра претендуют на пару электронов в равной степени, электронная
плотность сосредоточена как вокруг ядер, так и в пространстве между атомами.
Другой способ изображения атомных и
молекулярной орбиталей: густота точек отражает "электронную
плотность", то есть вероятность нахождения электрона в какой-либо точке
пространства около ядер атомов водорода. Видно, что значительная электронная
плотность сосредоточена в пространстве между двумя ядрами в молекуле водорода.
Американский химик Дж. Льюис в 1916 году
предложил обозначать электроны точками рядом с символами элементов. Одна
точка обозначает один электрон.
В этом случае образование молекулы водорода из атомов записывается так:
Оказалось,
что формулы Льюиса имеют глубокий химический смысл. Мы видим, что связь между
атомами водорода обозначается парой электронов. Как предположил Льюис, именно пара электроновпозволяет
образовать ковалентную связь. Впоследствии это предположение подтвердилось
квантовой теорией.
Ковалентной связью называется связывание атомов с помощью общих
(поделенных между ними) электронных пар.
Рассмотрим связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в
двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого
запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной
оболочки:
На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Поскольку электроны
нижних уровней не принимают участия в химическом взаимодействии, точками мы
обозначили только электроны внешнего,
третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех
электронных пар и одного неспаренного электрона.
После объединения атомов в молекулу из двух неспаренных электронов
атомов получается новая электронная пара:
При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться,
если обвести кружком любой из атомов хлора.
Ковалентную связь образует только пара электронов, находящаяся между
атомами. Она называется поделенной
парой. Остальные пары электронов называют неподеленными
парами. Они заполняют оболочки и не принимают участие в связывании.
Льюис не только предложил теорию ковалентной связи, но и первым
сформулировал правило октета-дублета, которым мы уже пользовались в прошлой
главе для объяснения устойчивости атомов. Это правило применительно к
химическим связям можно сформулировать так:
атомы образуют химические связи в результате обобществления
такого количества электронов, чтобы приобрести электронную конфигурацию,
подобную завершенной электронной конфигурации атомов благородных элементов.
Два атома водорода, объединившись в молекулу, приобрели
“завершенную” молекулярную оболочку, подобную завершенной
электронной оболочке атома благородного газа гелия (1s2).
Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную
оболочку атома аргона (...3s23p6).
Полярная ковалентная связь занимает промежуточное положение
между чисто ковалентной связью и ионной связью. Так же, как и ионная, она может
возникнуть между двумя атомами разных видов. В полярной ковалентной связи
электроны смещаются от атома к атому не так сильно, как в ионной. Это
происходит тогда, когда атомам энергетически невыгодно далеко “отпускать” свои
собственные электроны, отданные в общую “копилку” – молекулярную орбиталь. Если
электроны слишком далеко сдвинутся к одному из атомов, молекулярная орбиталь
перестанет быть похожей на “октетную”. В то же время у разных атомов разные
донорные и акцепторные свойства, поэтому связывающая электронная пара не
располагается точно посередине между ядрами, как в ковалентной связи.
В качестве примера рассмотрим образование воды в реакции между атомами
водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать
электронные формулы для внешних оболочек водорода (1s1) и кислорода
(...2s2 2p4). Затем на помощь приходят формулы
Льюиса, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в
молекуле воды:
Оказывается, для этого необходимо взять именно два
атома водорода на один атом кислорода. Однако природа такова, что акцепторные
свойства атома кислорода выше, чем у атома водорода (о причинах этого чуть
позже). Поэтому связывающие электронные пары в формуле Льюиса для воды слегка
смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а
на атомах появляются частичные положительные и отрицательные заряды.
О том, как предсказать акцепторные свойства атомов и
где проходит “граница” между полярной ковалентной и ионной связями мы поговорим
в параграфе 3.4.
По теории Льюиса и правилу октета связь между атомами
может осуществляться не обязательно одной, но и двумя и даже тремя поделенными парами, если этого требует правило октета.
Такие связи называются двойными и тройными. Например, только что рассмотренный нами кислород
может образовывать двухатомную молекулу с октетом электронов у каждого атома только
тогда, когда между атомами помещаются две поделенные пары:
Атомы азота (...2s2 2p3 на последней оболочке) также связываются в двухатомную
молекулу, но для организации октета электронов им требуется расположить между
собой уже три поделенные пары:
В настоящее время принято изображать электронные пары
(то есть химические связи) между атомами черточками. Каждая черточка – это поделенная пара электронов. В
этом случае уже знакомые нам молекулы выглядят так:
Формулы с черточками между атомами называются структурными
формулами. Чаще в структурных
формулах не изображают неподеленные пары электронов, но в ряде случаев (мы
столкнемся с ними при обсуждении донорно-акцепторных связей) неподеленные пары
играют важную роль.
Структурные формулы очень хороши для изображения молекул: они четко
показывают – как атомы связаны между собой, в каком порядке, какими связями.
Связывающая пара электронов в формулах Льюиса – то же самое, что одна
черточка в структурных формулах.
Двойные и тройные связи имеют общее название – кратные связи. О молекуле
азота говорят, что она имеет порядок
связи, равный трем. В молекуле
кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора
– один. У водорода и хлора уже не кратная, а простая связь.
Порядок связи – это число обобществленных поделенных пар между двумя
связанными атомами. Порядок связи выше трех не встречается.
Таблица Длины и прочности связей между атомами
азота в различных соединениях
Связь
|
Длина связи в ангстремах 1А = 10–8см
|
Прочность связи в кДж на одинаковое число молекул
|
|
Проcтая
N–N
|
1,45
|
58,5
|
|
Двойная
N=N
|
1,25
|
456
|
|
Тройная
|
1.098
|
945
|
Рассмотрим данные по длинам и прочностям связей между атомами азота в
различных его соединениях. В таблице длины связей приведены в специальных
единицах – ангстремах (1А = 10–8см). Относительную прочность связей
можно оценить по энергии, которая необходима для разрыва связей между атомами
азота в разных соединениях. Эта энергия дается для одинакового числа молекул
таких соединений. Чем выше кратность связи, тем она короче и прочнее.
Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче
сама связь.
УПРАЖНЕНИЯ
1. Атомы водорода и фосфора имеют
одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина РН3?
Решение: В молекуле фосфина РН3 ковалентная неполярная химическая
связь.
_____________________________________________________________
2.
В
какой из молекул – хлороводорода HCl или фтороводорода HF - ковалентная
химическая связь более полярна?
Решение:
На основании ряда
электроотрицательности неметаллов фтор электроотрицательнее хлора, потому
ковалентная связь в молекуле фтороводорода HF более полярная, чем в молекуле
хлороводорода HCl.
_____________________________________________________________
3. Определите тип химической связи и запишите схему ее
образования для веществ с формулами: а) S2, K2O, H2S;
б) N2, Li3N, Cl3N.
Решение:
а)ковалентная неполярная: S2ковалентная полярная: H2S
ионная: K2O.
б)ковалентная неполярная: N2
ковалентная полярная: Cl3N
ионная: Li3N.
ковалентная полярная: Cl3N
ионная: Li3N.
_____________________________________________________________
4. В следующих предложениях вставьте пропущенные слова и выражения:
«Ковалентная химическая связь образуется за счет … . По числу общих электронных
пар она бывает … . По ЭО ковалентную связь делят на … и …».
Решение:
Ковалентная химическая связь образуется за
счет образования общих
электронных пар. По числу общих электронных пар она бываетодинарной,
двойной, тройной. По ЭО ковалентную связь делят на полярную и неполярную.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Какова природа сил, которые обусловливают
химическую связь.
2.
Какие структуры
могут образоваться в результате
связывания атомов.
3.
Какие электроны называются валентными
электронами.
4.
Как объяснял образование
ковалентной связи Г. Льюис.
5.
Как изменяется энергия системы
взаимодействующих атомов при образовании химической связи.
6.
Что происходит с электронными
облаками при образовании ковалентной связи.
7.
Что представляет собой область
перекрывания электронных облаков.
8.
Что характеризует
электроотрицательность элемента.
9.
Определите, как изменяется
прочность соединений в ряду: НF, HCl,
HBr, HI.
10.
Какая из химических связей
H-Cl, H-Br, H-I,
H-S, H-P является наиболее полярной. Укажите, в какую
сторону смещается электронная плотность связи.
|
1.
Какая химическая
связь наименее прочная:
|
|
|
а) металлическая
|
б) ионная
|
|
в) водородная
|
г) ковалентная
|
|
2.
Охарактеризуйте связь в молекуле азота:
|
|
|
а) тройная
|
б) 1σ и 2π
|
|
в) все ответы верны
|
г) очень прочная
|
|
3.
Атомы какого элемента проявляет наибольшую
склонность к образованию ионных связей:
|
|
|
а) С
|
б) Si
|
|
в) F
|
г) P
|
|
4.
Выберите формулы веществ, в которых все связи
ковалентные полярные:
|
|
|
а) Н2О2
|
б) NH4NO3
|
|
в)N2
|
г) H2O
|
|
5.
Только ковалентные неполярные связи содержатся в молекулах:
|
|
|
а) P4
|
б) NH3
|
|
в) NH4NO
|
г) H2O
|
|
6.
Укажите формулу молекулы с наибольшим числом
ковалентных связей:
|
|
|
а) Н2О2
|
б) NH3
|
|
в) P4
|
г) N2
|
|
7.
Между молекулами каких веществ могут образоваться
водородные связи:
|
|
|
а) воды
|
б) пероксида водорода
|
|
в) водорода
|
г) фтора
|
|
8.
Охарактеризуйте химические связи в молекуле воды:
|
|
|
а) водородная
|
б) ковалентная неполярная
|
|
в) 2 связи σ-типа
|
г) 1σ и 1π связь
|
|
9.
Молекула СО2 содержит связи:
|
|
|
а) 1σ и 1π
|
б) 2σ и 2π
|
|
в) 3σ и 1π
|
г) 4σ
|
|
10.
Только
ковалентные полярные связи содержатся в молекулах:
|
|
|
а) Н2О2
|
б) NH3
|
|
в) NH4NO3
|
г) P4
|
Ответы:
|
1
|
в
|
|
2
|
в
|
|
3
|
в
|
|
4
|
г
|
|
5
|
а
|
|
6
|
в
|
|
7
|
а
|
|
8
|
в
|
|
9
|
б
|
|
10
|
б
|
















Комментариев нет:
Отправить комментарий