6.4.
Соли, их свойства и получение
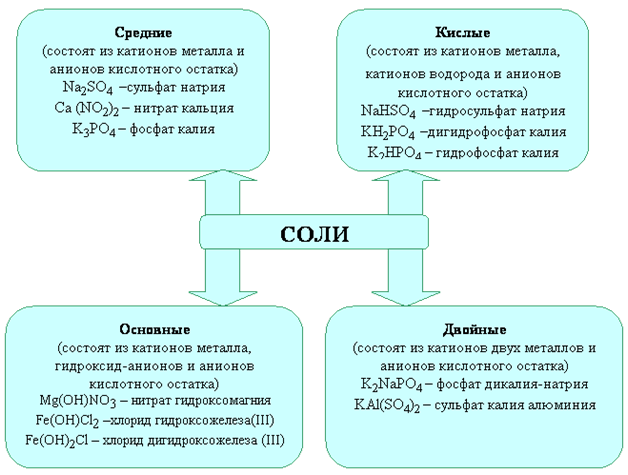
Классификация и номенклатура солей
С точки зрения теории электролитической диссоциации соли это соединения,
при диссоциации которых образуются катионы металлов и анионы ОН– .
Различают следующие типы солей: средние,
кислые, основные, двойные, смешанные и комплексные .
В средних солях все атомы водорода соответствующей кислоты
замещены на атомы металла. Уравнение диссоциации средней соли Na2SO4 в
разбавленном растворе записывается следующим образом:
Na2SO4 → 2 Na+ + SO42– ,
(NH4)2Cr2O7 → 2 NH4+ + Cr2O72– ,
при этом указывается,
что степень диссоциации стремится к единице
(α  1)
1)
В кислых солях атомы водорода соответствующей кислоты не
полностью замещены на металл. Кислая соль получается по реакции
неполной нейтрализации кислоты:
H2SO3 + NaOH(недостаток) → NaHSO3 +
H2O,
или при взаимодействии
средней соли с избытком кислоты:
Ca3(PO4)2 + 4 H3PO4(избыток) → 3
Ca(H2PO4)2.
Для перевода кислой соли
в среднюю следует добавить основание:
NaHSO4 + NaOH → Na2SO4 +
H2O,
Са(НСО3)2 + Са(OH)2 → СаСО3 +
2H2O.
Диссоциацию кислой соли
можно выразить уравнением:
NaHCO3 → Na+ +
HCO3–; α1
Анион HCO3 -
будет диссоциировать в незначительной степени:
HCO3– ⇌ H+ +
CO32–.
Кислые соли образуются
многоосновными кислотами.
Основные соли – это продукт неполного замещения групп ОН– основания
на кислотные остатки:
Mg(OH)2 + НС1(недост) → MgOHС1 + H2O.
Основные соли образуют
основания, содержащие две и более гидроксо-групп.
Для перевода основной
соли в среднюю необходимо добавить кислоту:
Mg(OH)Cl + HCl → MgCl2 + H2O.
Диссоциация основной
соли выражается уравнением:
Mg(OH)Cl → MgOH+ + Cl–; α → 1.
Катион MgOH+
подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH–.
Специфические химические свойства солей зависят от
того, какой катион и какой анион образуют данную соль.
Специфические свойства солей по катиону
|
Специфические свойства солей по аниону
|
Ag+ + Cl- = AgCl↓ белый
творожистый осадок
Cu2+ + 2OH- = Cu(OH)2↓
синий осадок
Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический
осадок
Fe3+ + 3SCN- = Fe(SCN)3 кроваво-красное
окрашивание
Al3+ + 3OH- = Al(OH)3↓
белый желеобразный осадок
Ca2+ + CO32- = CaCO3↓ белый осадок
|
Ag+ + Cl- = AgCl↓ белый
творожистый осадок
Ba2+ + SO42- = BaSO4↓ белый мелкокристаллический
осадок
2H+ + SO32- = H2O + SO2↑ газ с резким запахом
2H+ + CO32- = H2O + CO2↑ газ без запаха
3Ag+ + PO43- = Ag3PO4↓ жёлтый осадок
2H+ + S2- = H2S↑ газ с
неприятным запахом тухлых яиц
|
Двойные соли – это соли, состоящие из двух различных катионов и одного аниона.
Примерами двойных солей являются: алюмокалиевые квасцы KAl(SO4)2 и
сильвинит KCl·NaCl.
Диссоциацию двойной соли в разбавленном растворе можно выразить уравнением:
KAl(SO4)2 → K+ + Al3+ + 2SO42–; α → 1.
Смешанные соли – это соли, состоящие из одного катиона и двух различных анионов.
Хлорная известь CaOCl2, например, является солью хлорноватистой
(НС1О) и хлороводородной (НС1) кислот.
В состав комплексных солей входит комплексный ион (в
формулах он заключается в квадратные скобки), состоящий из центрального атома -
комплексообразователя, окруженного несколькими частицами – молекулами или
ионами (лигандами). В разбавленных растворах комплексная соль диссоциирует
следующим образом:
K3[Fe(CN)6] → 3 K+ + [Fe(CN)6]3– ; α →1.
В свою очередь, комплексный ион является слабым электролитом и в
незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3– → Fe3+ + 6 CN–.
Название солей состоит из названия аниона в именительном падеже, за которым
следует название катиона в родительном. Если один и тот же металл может
проявлять в соединении различную степень окисления, то ее указывают в скобках
римской цифрой.
В названии солей кислородсодержащих кислот к латинскому корню названия
элемента добавляется окончание –ат (для высших степеней окисления), -ит для
более низких. Например, KNO3 – нитрат калия, KNO2 –
нитрит калия, FeSO4 – сульфат железа (II), Fe2(SO4)3 –
сульфат железа (III).
Суффикс –ид добавляется к названию неметалла при наименовании солей
бескислородных кислот, например, NaCl – хлорид натрия.
Названия кислых солей образуют, добавляя к наименованию аниона приставку
гидро-. Например, NaHS – гидросульфид натрия, KH2PO4 –
дигидрофосфат калия.
Названия основных солей образуют прибавлением к названию аниона приставки
гидроксо–: Mg(OH)SO4 – гидроксосульфат магния, Al(OH)2Cl
– дигидроксохлорид алюминия.
Большинство способов получения солей обсуждено выше, при рассмотрении свойств
оксидов, оснований и кислот. Ниже приводятся важнейшие реакции получения солей:
Реакция нейтрализации:
КОН + НС1 = КС1 + H2O,
Al(OH)3 + 3
HNO3 → Al(NO3)3 + 3H2O,
Cu(OH)2 + 2
HCl → CuCl2 + 2H2O.
Взаимодействие металлов
с кислотами:
Zn + 2 HCl → ZnCl2 +
H2↑,
Ca + H2SO4(разб) → CaSO4 + H2↑ .
Взаимодействие кислот с
основными оксидами:
2 HNO3 +
CaO → Ca(NO3)2 + H2O,
3 H2SO4 +
Fe2O3 → Fe2(SO4)3 +
3H2O.
Взаимодействие кислот с солями:
H2SO4 +
Na2CO3 → Na2SO4 + CO2↑ + H2O,
HCl + AgNO3 → AgCl↑ + HNO3.
Взаимодействие растворимых оснований с солями:
Fe2(SO4)3 +
6 KOH → 2 Fe(OH)3 ↑ + 3 K2SO4,
NiCl2 + 2
KOH → Ni(OH)2↑ + 2KCl.
Взаимодействие основных
оксидов с кислотными:
CaO + CO2 → CaCO3,
BaO + SiO2 → BaSiO3 .
Взаимодействие оснований
с кислотными оксидами:
Ba(OH)2 + N2O5 → Ba(NO3)2 + H2O,
2 KOH + SO2 → K2SO3 +
H2O.
Взаимодействие двух
растворимых солей:
CaCl2 + K2CO3 → CaCO3↑ + 2 KCl.
3 Ba(NO3)2 +
2 K3PO4 → Ba3(PO4)2↑ + 6 KNO3.
При непосредственном
взаимодействии металлов и неметаллов могут быть получены соли бескислородных
кислот:
Zn + S → ZnS,
2 Fe + 3 Cl2 → 2 FeCl3.
Помимо приведенных выше,
существуют и другие способы получения солей.
Соли, как правило, являются твердыми кристаллическими веществами, с
различной растворимостью в воде. По растворимости в воде соли можно разделить
на хорошо растворимые и малорастворимые. Хорошо растворяются в воде все
нитраты, соли аммония и большинство солей щелочных металлов. К числу
малорастворимых солей относятся большинство карбонатов, фосфатов и силикатов
(кроме солей щелочных металлов и аммония).
Многие растворимые соли взаимодействуют между собой в растворах при условии
образования осадков малорастворимых солей или выделения газов:
BaCl2 + Na2SO4 → BaSO4↑ + 2NaCl,
Na2CO3 + Ca(NO3)2 → CaCO3↑ + 2NaNO3,
2 NH4HSO4 + Ba(HCO3)2 → BaSO4↑ + (NH4)2SO4 + 2 H2O
+ CO2 ↑.
Растворы некоторых солей реагируют с металлами. При составлении уравнений
реакций необходимо пользоваться рядом электродных потенциалов (рядом
напряжений) металлов, поскольку более активные металлы, например цинк и железо,
вытесняют менее активные (Сu, Ag) из растворов их солей:
Fe + CuSO4 → Cu↑ + FeSO4,
Zn + Pb(NO3)2 → Pb↑ + Zn(NO3)2.
Растворы солей реагируют со щелочами при условии образования осадков
малорастворимых оснований:
FeCl3 + 3 KOH → Fe(OH)3↑ + 3 KCl,
Pb(NO3)2 + 2NaOH → Pb(OH)2↑ + 2 NaNO3.
Cоли слабых кислот
реагируют с сильными кислотами:
Na2SiO3 + 2 HCl → H2SiO3↑ + 2 NaCl,
NiCl2 + H2S → NiS↑ + 2 HCl,
CaCO3 + 2 HCl → CaCl2 + CO2↑ + H2O.
Термически неустойчивы и разлагаются при нагревании все нитраты, соли
аммония и кислые соли (при разложении последних всегда выделяется вода):
2 KNO3 → 2 KNO2 + O2↑,
4 Fe(NO3)3 → 2 Fe2O3 + 12 NO2 + 3 O2↑,
2 AgNO3 → 2 Ag + 2 NO2↑ + O2↑,
NH4NO3 → N2O↑ + 2H2O
,
NH4Cl → NH3↑ + HCl↑ ,
2 NaHCO3 → Na2CO3 + CO2↑ + H2O.
Продукты термического разложения нитратов
зависят от положения катиона металла в ряду напряжений металлов.
Примечание. Индексы, зависящие от степени окисления
металла (М), не указаны.
УПРАЖНЕНИЯ
1. Из приведённого перечня выберите соли, назовите
их, определите тип.
1) КNO2 2) LiOH 3) CaS 4) CuSO4 5) P2O5 6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
1) КNO2 2) LiOH 3) CaS 4) CuSO4 5) P2O5 6) Al(OH)2Cl 7) NaHSO3 8) H2SO4
Решение:
1) Нитрит калия – средняя соль
3) Сульфид кальция – средняя соль
4) Сульфат меди (II) – средняя соль
6) Дигидроксохлорид алюминия – основная соль
7) Гидросульфит натрия – кислая соль
1) Нитрит калия – средняя соль
3) Сульфид кальция – средняя соль
4) Сульфат меди (II) – средняя соль
6) Дигидроксохлорид алюминия – основная соль
7) Гидросульфит натрия – кислая соль
________________________________________________________________
2. С какими из перечисленных веществ может реагировать а) BaCl2 б) CuSO4 в) Na2CO3?
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3 6)Na2SO4 7)BaCl2 8)Fe 9)Cu(OH)2 10) NaOH
1)Na2O 2)HCl 3)H2O 4) AgNO3 5)HNO3 6)Na2SO4 7)BaCl2 8)Fe 9)Cu(OH)2 10) NaOH
Решение:
BaCl2 реагирует с веществами 4,6,
CuSO4 реагирует с веществами 4,7,8,10
Na2CO3 реагирует с веществами 2,4,5,7
BaCl2 реагирует с веществами 4,6,
CuSO4 реагирует с веществами 4,7,8,10
Na2CO3 реагирует с веществами 2,4,5,7
________________________________________________________________
3. Через раствор, содержащий 60 г NaOH, пропустили 44,8 л СО2.
Найти массу образовавшейся соли.
Решение:
V(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
V(СО2) = V/Vm =
44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку V(NaOH)
: V(CO2)
= 1,5 : 2 = 0,75 : 1, то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества
образовавшейся соли равно количеству вещества прореагировавшего гидроксида
натрия:
V(NaHCO3) =
1,5 моль.
m(NaHCO3) = M •V =
84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) =
126 г.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Kакие из
перечисленных веществ, находящихся в водных растворах, могут реагировать с
водным раствором какой-либо соли: хлорид натрия, нитрат калия, нитрат меди(II),
сульфат аммония, сульфат железа(II), гидроксид натрия, углекислый газ, сульфид
калия, гидроксид алюминия, сероводород, оксид кремния?
Напиши
уравнения соответствующих реакций.
………………………………………………………………………………………
………………………………………………………………………………………
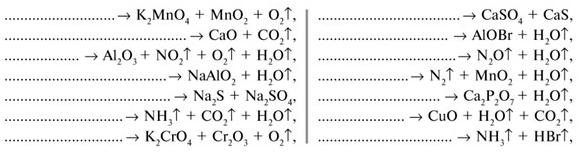
2. Напиши уравнения реакций, протекающих без
изменения С.О. атомов по схеме:
………………………………………………………………………………………
3. Приведи вариант химических символов для
букв X, Y , Z и V в следующих уравнениях реакций:
а) X(ZY)2 + FeSZ4 ↓ XSZ4↓ + Fe(ZY)2↓ ........................................................................
;
б) NaZX + YVZ3 ↓ Y2Z↓ + X2Z + NaVZ3 ......................................................................
;
4. Напиши уравнения реакций, протекающих без изменения С.О. атомов
по схеме:
5. Составь уравнения реакций,
соответствующие схемам:
1) Al → Al(NO3)3 → Al(OH)3 → K3[Al(OH)6] → Al(OH)3 → Al2O3 → Al2(SO4)3;
2) N2 → NO → NO2 → HNO3 → AgNO3 → HNO3 → N2 → Na3N → NH3 → NH4OH → NH4Cl;
6. Составь уравнения реакций термического разложения
веществ:
1)
(NH4)3PO4, Al(OH)3,
HNO3, Na[Al(OH)4], HCl, Na2CO3.
7. Допиши уравнения термического разложения
веществ:
8. Составьте уравнения реакций получения
кислых солей из сернистой кислоты и гидроксидов натрия и бария.
9.
Составьте
формулы основных хлоридов железа (III) и уравнения реакций (в молекулярном и ионном виде)
превращения этих солей в нормальную соль – хлорид железа (III).
10. Заполни таблицу по химическим свойствам
солей (укажи продукты реакции).
Вещества-реагенты
|
Продукты реакции с солью
|
||
растворимой
|
нерастворимой
|
||
Вода
|
………………………..
|
………………………..
|
|
Основный оксид
|
………………………..
|
………………………..
|
|
Амфотерный оксид
|
………………………..
|
………………………..
|
|
Kислотный оксид
|
………………………..
|
………………………..
|
|
Основание
|
растворимое
|
………………………..
|
………………………..
|
нерастворимое
|
………………………..
|
………………………..
|
|
Амфотерный гидроксид
|
………………………..
|
………………………..
|
|
Kислота
|
………………………..
|
………………………..
|
|
Соль
|
растворимая
|
………………………..
|
………………………..
|
нерастворимая
|
………………………..
|
………………………..
|
|
Металл
|
………………………..
|
………………………..
|
|
Неметалл
|
………………………..
|
………………………..
|
|
Термическое разложение
|
Продукты разнообразны
|
||
ВИДЕО ОПЫТ
1.
Укажите название кислоты, которая может
образовывать кислые соли:
|
|
а) метафосфорная
|
б) азотная
|
в) угольная
|
г) уксусная
|
2.
Какие кислоты не могут образовывать кислые соли:
|
|
а) сероводородная
|
б) все ответы верны
|
в)серная
|
г) азотистая
|
3.
Два типа кислых солей образует кислота:
|
|
а) угольная
|
б) сернистая
|
в) сероводородная
|
г) ортофосфорная
|
4.
Какой оксид, реагируя со щелочами, не может
образовать кислую соль:
|
|
а) оксид фосфора(V)
|
б) оксид серы (IV)
|
в) оксид углерода(IV)
|
г) оксид азота(V)
|
5.
У каких
солей заряд кислотного остатка равен -1:
|
|
а) все ответы верны
|
б) гидросульфит кальция
|
в) дигидрофосфат натрия
|
г) гидросульфат калия
|
6.
С какими веществами при определенных условиях не
реагирует карбонат натрия:
|
|
а) оксидом кремния (IV)
|
б) хлоридом бария
|
в) ортофосфорной кислотой
|
г) гидроксидом калия
|
7.
Какие вещества, реагируя с раствором хлорида
бария, образуют соль:
|
|
а) все ответы верны
|
б) серная кислота
|
в) сульфат натрия
|
г) карбонат калия
|
8.
Реагируя с какими веществами в водном растворе гидроксид
кальция может образовать карбонат кальция:
|
|
а) угарный газ
|
б) гидрокарбонат калия
|
в) натрием
|
г) избыток углекислого газа
|
9.
С какими солями реагирует водный раствор
гидроксида натрия:
|
|
а) все ответы верны
|
б) гидрокарбонатом натрия
|
в) хлоридом меди (II)
|
г) сульфатом железа (III)
|
10.
Какие металлы вытесняют медь из водного раствора
сульфата меди (II):
|
|
а) железо
|
б) серебро
|
в) натрий
|
г) все ответы верны
|
Ответы:
1
|
в
|
2
|
г
|
3
|
г
|
4
|
г
|
5
|
а
|
6
|
г
|
7
|
а
|
8
|
б
|
9
|
а
|
10
|
а
|




Комментариев нет:
Отправить комментарий