7.8. Важнейшие соединения марганца и меди
Свойства
элементов подгруппы марганца
Атомный
номер |
Название
|
Электронная
конфигурация |
ρ
г/см3 |
t0пл.
0C |
t0кип.
0C |
ЭО
|
Атомный
радиус, нм |
Степень
окисления |
25
|
Марганец Mn
|
[Ar] 3d54s2
|
7,45
|
1244
|
1962
|
1,6
|
0,131
|
+2,+3,+4,
+5,+6,+7 |
43
|
Технеций Tc
|
[Kr] 4d55s2
|
11,5
|
2172
|
4876
|
1,36
|
0,136
|
+2,+3,+4,
+5,+6,+7 |
75
|
Рений Re
|
[Xe] 4f145d56s2
|
20,53
|
3180
|
5600
|
1,46
|
0,137
|
+3,+4,+5,
+6,+7 |
Физические свойства: Серебристо-белые, тугоплавкие металлы.
Химические свойства
В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней
активности, в ряду напряжений стоит до водорода и растворяется в соляной и
серной кислотах:
Mn + 2H+ →Mn2+ + H2
Re и Tc стоят в ряду
напряжений после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO3→ 3HTcO4 +
7NO↑ + 2H2O
С увеличением степени окисления усиливается кислотный характер оксидов и
гидроксидов. (RO – основные; R2O7 – кислотные, им
соответствуют кислоты HRO4).
Марганец
и его соединения. Марганец
Электронная конфигурация
валентного слоя
Получение
Алюмотермия: 3MnO2 +
4Al → 2Al2O3 +
3Mn
Химические свойства
Металл средней
активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с
неметаллами, например, с серой:
Mn + S → MnS
Растворяется в кислотах:
Mn + 2HCl → MnCl2 + H2↑
(При этом образуются соединения двухвалентного марганца).
Растворяется в кислотах:
Mn + 2HCl → MnCl2 + H2↑
(При этом образуются соединения двухвалентного марганца).
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного
пиролюзита MnO2 водородом:
MnO2 + H2 → MnO + H2O
Гидроксид марганца (II) Mn(OH)2 - светло-розовое
нерастворимое в воде основание:
MnSO4 +
2NaOH → Mn(OH)2 ↑+ Na2SO4
Mn2+ + 2OH- → Mn(OH)2
Mn2+ + 2OH- → Mn(OH)2
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl → MnCl2 + 2H2O
Mn(OH)2 + 2H+ → Mn2+ + 2H2O
Mn(OH)2 + 2HCl → MnCl2 + 2H2O
Mn(OH)2 + 2H+ → Mn2+ + 2H2O
На воздухе Mn(OH)2 быстро
темнеет в результате окисления:
2Mn(OH)2 + O2 +
2H2O →2[MnO2· 2H2O]
При действии сильных
окислителей наблюдается переход Mn2+ в MnO2-:
2Mn(OH)2 + 5Br2 +
12NaOH → 2NaMnO4 + 10NaBr + 8H2O (кат.CuSO4)
2Mn(NO3)2 + 5PbO2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO→ 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO→ 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
Оксид марганца (IV) MnO2 - тёмно-коричневый порошок,
нерастворимый в воде. Образуется при термическом разложении нитрата марганца
(II):
Mn(NO3)2 → MnO2 +
2NO2
При сильном нагревании
теряет кислород, превращаясь в Mn2O3 (при 6000C)
или Mn3O4 (при 10000C).
Сильный окислитель:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
Сильный окислитель:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
При сплавлении с содой и селитрой образует манганат натрия тёмно - зелёного
цвета:
MnO2 + Na2CO3 +
NaNO3 → Na2MnO4 + NaNO2 + CO2↑
Манганаты также могут
быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 +
2KMnO4 + 2KOH→ Na2SO4 + 2K2Mn+6O4 +
H2O
Гидролиз манганатов
протекает по схеме:
3K2MnO4 + 2H2O ⇌ 2KMnO4 +
MnO2 + 4KOH
3MnO42- + 2H2O ⇌ 2MnO4- +
MnO2 + 4OH-
За способность обратимо менять окраску манганат калия называют
"минеральным хамелеоном".
Оксид марганца (VII) Mn2O7 - тёмно-зелёная
жидкость, кислотный оксид. Получают действием концентрированной серной кислоты
на кристаллический KMnO4 (марганцевая кислота HMnO4
нестабильна):
2KMnO4 + H2SO4 → Mn2O7↑ + K2SO4 +
H2O
При растворении в
щелочах образует перманганаты:
Mn2O7 + 2KOH → 2KMnO4 +
H2O
Перманганат калия KMn+7O4 -тёмно-фиолетовое
кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением
кислорода:
2KMnO4→ K2MnO4 +
MnO2 + O2
Сильный окислитель,
причём восстанавливается в кислой среде до Mn2+, в нейтральной – до
Mn+4O2, а в щелочной – до Mn+6O42-.
Свойства элементов подгруппы меди
Атомный
номер
|
Название
|
Электронная
конфигурация
|
ρ
г/см3 |
t0пл. 0C
|
t0кип. 0C
|
ЭО
|
Атомный
радиус,
нм |
Удельная
злектро- проводность м,мм-2,ом-1
|
Степень
окисления
|
29
|
Медь
Cu
|
[Ar]
3d104s1
|
8,96
|
1083
|
2595
|
1,9
|
0,127
|
58,1
|
+1,+2
|
47
|
Серебро
Ag
|
[Kr]
4d105s1
|
10,5
|
960
|
2180
|
1,9
|
0,144
|
61,0
|
+1
|
79
|
Золото
Au
|
[Xe]4f145d106s1
|
19,3
|
1064
|
2700
|
2,4
|
0,144
|
41,3
|
+1,+3
|
Физические свойства
Высокие значения плотности, температур плавления и кипения.
Высокая тепло- и электропроводность.
Химические свойства
Химическая активность небольшая, убывает с увеличением атомного номера.
Медь
и её соединения.
Получение
Пирометаллургия:
CuO + C →Cu + CO
CuO + CO → Cu + CO2
Гидрометаллургия:
CuO + H2SO4 → CuSO4 + H2O
CuSO4 + Fe → FeSO4 + Cu
CuSO4 + Fe → FeSO4 + Cu
Электролиз:
2CuSO4 + 2H2O → 2Cu + O2↑ + 2H2SO4
(на катоде) (на аноде)
Химические
свойства
Взаимодействует с
неметаллами при высоких температурах:
2Cu + O2 → 2CuO
Cu + Cl2 → CuCl2
Cu + Cl2 → CuCl2
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с
разбавленными соляной и серной кислотами, но растворяется в кислотах –
окислителях:
3Cu + 8HNO3(разб.) →3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3(конц.) →Cu(NO3)2 + 2NO2↑ + 2H2O
Cu + 2H2SO4(конц.)→ CuSO4 + SO2↑+2H2O
Cu + 4HNO3(конц.) →Cu(NO3)2 + 2NO2↑ + 2H2O
Cu + 2H2SO4(конц.)→ CuSO4 + SO2↑+2H2O
Сплавы меди с оловом -
бронзы, с цинком - латуни.
Соединения
одновалентной меди
Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S,
CuCl), либо в виде растворимых комплексов (координационное число меди – 2):
CuCl + 2NH3 → [Cu(NH3)2]Cl
Оксид меди (I) - красного цвета, получают восстановлением соединений меди
(II), например, глюкозой в щелочной среде:
2CuSO4 +
C6H12O6 + 5NaOH → Cu2O + 2Na2SO4 + C6H11O7Na
+ 3H2O
Соединения
двухвалентной меди
Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных
восстановителей (например, CO) до меди. Обладает основным характером, при
нагревании растворяется в кислотах:
CuO + H2SO4 → CuSO4 +
H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество
светло-голубого цвета. Образуется при действии щелочей на соли меди (II):
CuSO4 + 2NaOH → Cu(OH)2↑ + Na2SO4
При нагревании чернеет,
разлагаясь до оксида:
Cu(OH)2 → CuO + H2O
Типичное основание.
Растворяется в кислотах.
Cu(OH)2 + 2HCl → CuCl2 +
2H2O
Cu(OH)2 + 2H+ → Cu2+ + 2H2O
Cu(OH)2 + 2H+ → Cu2+ + 2H2O
Растворяется в растворе аммиака с образованием комплексного соединения
(координационное число меди – 4) василькового цвета (реактив Швейцера,
растворяет целлюлозу):
Cu(OH)2 +
4NH3→[Cu(NH3)4](OH)2
Малахит Cu2(OH)2CO3.
Искусственно можно получить по реакции:
2CuSO4 +
2Na2CO3 + H2O → Cu2(OH)2CO3↑ + 2Na2SO4 + CO2↑
Разложение малахита:
Cu2(OH)2CO3 → 2CuO + CO2↑ + H2O
Cu2(OH)2CO3 → 2CuO + CO2↑ + H2O
Серебро
и его соединения
Благородный металл, устойчивый на воздухе. При потускнении серебра
происходит реакция Гепара:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
В ряду напряжений находится правее водорода, поэтому растворяется только в
кислотах - окислителях:
3Ag + 4HNO3(разб.)→3AgNO3 + NO↑ + 2H2O
Ag + 2HNO3(конц.)→ AgNO3 + NO2↑+ H2O
2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2↑ + 2H2O
Ag + 2HNO3(конц.)→ AgNO3 + NO2↑+ H2O
2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2↑ + 2H2O
В соединениях серебро обычно проявляет степень окисления +1.
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Растворимый нитрат серебра AgNO3 используется как реактив для качественного определения Cl-, Br-, I-:
Ag+ + Cl- → AgCl↑белый
Ag+ + Br-→ AgBr↑ светло-жёлтый
Ag+ + I- → AgI↑ тёмно-жёлтый
Ag+ + Br-→ AgBr↑ светло-жёлтый
Ag+ + I- → AgI↑ тёмно-жёлтый
(Способность этих осадков образовывать растворимые комплексные соединения
уменьшаются в ряду AgCl – AgBr – AgI). На свету галогениды серебра постепенно
разлагаются с выделением серебра.
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
При добавлении растворов щелочей к раствору AgNO3 образуется тёмно-коричневый осадок оксида серебра Ag2O:
2AgNO3 + 2NaOH→ Ag2O +
2NaNO3 + H2O
Осадки AgCl и Ag2O растворяются в растворах аммиака с
образованием комплексных соединений (координационное число серебра – 2):
AgCl + 2NH3 → [Ag(NH3)2]Cl
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]OH
Золото - мягче Cu и Ag, ковкий металл; легко образует тончайшую фольгу;
благородный металл, устойчив как в сухом, так и во влажном воздухе. Растворим
только в смеси концентрированных соляной и азотной кислот ("царской
водке"):
Au + HNO3 +
4HCl → H[AuCl4] + NO + 2H2O
+ 2H2O
Реагирует с галогенами
при нагревании:
2Au + 3Cl2 →2AuCl3
Соединения термически не очень устойчивы и разлагаются при нагревании с
выделением металла. Комплексообразователь (комплексы золота (III) обладают
координационными числами 4, 5 и 6).
УПРАЖНЕНИЯ
1.
Подберите коэффициенты в уравнении
реакции, протекающей в нейтральной среде:
KMnO4 +
H2О + Na2SO3 → MnО2(т) + Na2SO4….
Решение:
2 KMnO4 + H2О + 3 Na2SO3 =
2 MnО2(т) + 3 Na2SO4 + 2 КОН
MnO4- + H2О+ 3 SO32- =
2 MnО2(т) + 3 SO42- + 2ОН-
MnO4- + 2 H2О + 3 e- = MnО2(т) + 4 ОН-
SO32- + H2O -2 e- = SO42- + 2 H+
8ОН- + 6 Н+ =
6 Н2О + 2 ОН-
Таким
образом, если реакцию из примера 10 проводят простым сливанием водных растворов
перманганата калия и сульфита натрия, то она протекает в условно нейтральной (а
в действительности, в слабощелочной) среде из-за
образования гидроксида калия. Если же раствор перманганата калия
немного подкислить, то реакция будет протекать в слабокислотной (условно
нейтральной) среде.
_________________________________________________________________
2. При погружении в
раствор медного купороса кадмиевой пластинки масса ее уменьшилась на 3 г.
Определите количество кадмия, перешедшего в раствор.
Решение:
CuSO4 + Cd = CdSO4 + Cu.
Поскольку масса 1 моль
меди меньше массы 1 моль кадмия, то в результате реакции происходит уменьшение
массы кадмиевой пластинки. При выделении на пластинке 64 г меди в раствор
одновременно перешло бы 112 г кадмия. При этом масса пластинки уменьшилась бы на
48 г
(112 – 64 = 48). Запишем соотношение: при уменьшении массы пластинки на 48 г в раствор переходит 112 г Cd, а при уменьшении массы пластинки на 3 г в раствор переходит х г Cd. Решение пропорции дает х = 3•112/48 = 7 г.
(112 – 64 = 48). Запишем соотношение: при уменьшении массы пластинки на 48 г в раствор переходит 112 г Cd, а при уменьшении массы пластинки на 3 г в раствор переходит х г Cd. Решение пропорции дает х = 3•112/48 = 7 г.
_________________________________________________________________
3.
2 г
сплава меди с алюминием обработали раствором щелочи. Остаток растворили в
разбавленной азотной кислоте, образовавшуюся при этом смесь выделили и
прокалили. Масса остатка после прокаливания составила 0,8 г. Определите
объем израсходованного 40%-го раствора гидроксида натрия (плотность
1,22 г/мл) и содержание металлов в сплаве.
Решение:
Для решения задачи необходимо знать химические
свойства меди и алюминия. Медь обладает металлическими свойствами и не
реагирует со щелочами. С раствором гидроксида натрия будет реагировать только
алюминий, который проявляет амфотерные свойства:
2Al + 2NaOH + 6H2O
= 2Na[Al(OH)4] + H2 (1)
Остатком является медь, которую растворили в разбавленной
азотной кислоте:
3Cu + 8HNO3 =
3Cu(NO3)2 + 2NO + 4H2O (2)
После выделения и прокаливания смеси образуется оксид
меди (II):
2Cu(NO3)2 =
2CuO + 4NO2 + O2 (3)
Определим массу меди в исходной смеси. Для этого
найдем количество вещества оксида меди (II), по условию задачи его масса
равна 0,8 г:
(моль).
По уравнению (3) 2 моль оксида меди (II)
образуется из 2 моль нитрата меди (II), (соотношение n(CuO)
: n(Cu(NO3)2) = 1 : 1), следовательно,
0,01 моль оксида меди (II) образуется из 0,01 моль нитрата
меди (II). По уравнению (2) из 3 моль меди дает 3 моль нитрата
меди (II) (соотношение n(Cu) : n(Cu(NO3)2)
= 1 : 1), тогда для образования 0,01 моль нитрата меди (II)
необходимо 0,01 моль меди. Количество вещества меди равно 0,01 моль.
Рассчитаем массу меди в исходной смеси:
m = n · M = 0,01 · 64 = 0,64 г.
По условию задача масса смеси равна 2 г,
определим массу алюминия:
m(Al) = m(смеси) – m(Cu) = 2 –
0,64 = 1,36 (г).
Рассчитаем массовые доли металлов в смеси:
(%);
(%).
Для определения объема израсходованного раствора
гидроксида натрия, необходимо определить количество вещества NaOH вступившего
во взаимодействие с алюминием. По уравнению реакции (1) 2 моль Al
реагирует с 2 моль NaOH (соотношение n(Al) : n(NaOH)
= 1 : 1). Количество вещества алюминий равно:
моль,
следовательно, количество вещества n (NaOH)
= 0,05 моль.
Определим массу гидроксида натрия:
m (в-ва) = n · M =
0,05 · 40 = 2 (г).
Вычислим массу раствора гидроксида натрия, зная
массовую долю NaOH в растворе:
(г).
Определим объем раствора 40%-го раствора гидроксида
натрия необходимый для взаимодействия:
(мл).
Ответ: V (p-pa NaOH) = 4,1 мл; ω (Cu)
= 32%, ω (Al) = 68%.
_________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Как изменяется характер оксидов и
гидроксидов марганца при увеличении его степени окисления.
2. Почему белый осадок гидроксида марганца
быстро темнеет на воздухе.
3. Какие степени окисления проявляет медь в
своих соединениях? Соединения с какой степенью окисления меди наиболее
устойчивы.
4. Почему растворы большинства солей меди (II) имеют сине-голубой цвет.
5. Определите степени окисления марганца и
меди в следующих соединениях:
.
6. Напишите уравнения реакций, с помощью
которых можно осуществить следующие превращения:
7. Напишите уравнения трех способов
получения: а) хлорида марганца (II); б) сульфата меди (II); в) оксида меди (II).
10. При растворении 3 г сплава меди и серебра в
концентрированной азотной кислоте получили 7,34 г смеси нитратов.
Определите массовые доли металлов в сплаве.
|
1.
Какой из металлов вытесняет
железо из сульфата железа (II):
|
|
|
а)
Сu
|
б)
Zn
|
|
в)
Sn
|
г) Hg
|
|
2.
Какой из металлов вытесняет медь
из сульфата меди (II):
|
|
|
а)
Hg
|
б)
Ag
|
|
в) Zn
|
г) Аu
|
|
3.
С водой без нагревания реагирует:
|
|
|
а)
цинк
|
б)
медь
|
|
в)
железо
|
г)
литий
|
|
4.
Без нагревания вода реагирует с:
|
|
|
а)
серебром
|
б)
железом
|
|
в)
медью
|
г)
кальцием
|
|
5.
Медь взаимодействует с раствором
соли:
|
|
|
а) KNO3
|
б) AgNO3
|
|
в) FeSO4
|
г) CaSO4
|
|
6.
Бром вступает в реакцию с:
|
|
|
а) фтороводородом
|
б) иодидом калия
|
|
в)
хлоридом натрия
|
г) гидроксидом меди (II)
|
|
7.
И бромоводородная кислота, и
гидроксид натрия реагируют с:
|
|
|
а) медью
|
б)
алюминием
|
|
в)
фосфором
|
г)
серой
|
|
8.
Водород получается при
взаимодействии:
|
|
|
а)
алюминия с раствором гидроксида натрия
|
б)
цинка с концентрированной азотной кислотой
|
|
в) меди
с соляной кислотой
|
г)
ртути с водой
|
|
9.
Возможна реакция при комнатной
температуре:
|
|
|
а)
железа с конц. серной кислотой на холоду
|
б)
серебра с разб. серной кислотой
|
|
в)
кальция с водой
|
г) меди
с водой
|
|
10.
Возможна реакция:
|
|
|
а)
ртути с серой
|
б) меди
с раствором хлорида магния
|
|
в)
железа с раствором гидроксида натрия
|
г)
алюминия с концентрированной серной кислотой на холоду
|
Ответы:
|
1
|
б
|
|
2
|
в
|
|
3
|
г
|
|
4
|
г
|
|
5
|
б
|
|
6
|
б
|
|
7
|
а
|
|
8
|
а
|
|
9
|
в
|
|
10
|
а
|








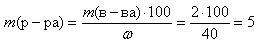


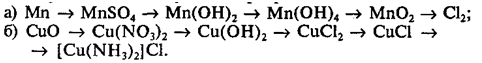

Комментариев нет:
Отправить комментарий