Раздел 9. Основные положения органической химии. Углеводороды
9.1.
Основные положения органической химии
Основные
положения теории химического строения органических веществ
Основные
положения:
1. Органическая химия – изучает соединения углерода (кроме
простейших - СО, СО2, угольной кислоты и её солей)
2. Органогены – химические элементы, входящие в состав
органических соединений – С, H,N, O, P, S – основа жизни белков, жиров, углеводов,
витаминов и др.
3. Органическая химия как наука зародилась к началу XIX века,
когда были синтезированы первые органические вещества:
1824 г. – Вёлер синтезирует
щавелевую кислоту,
1854 г. – Бертло синтезирует жиры,
1861г. – Бутлеров синтезирует один
из углеводов.
4. Положение в органической химии к
1861 году.
Химики-органики не могли объяснить,
почему:
·
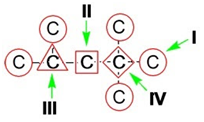
в органических соединениях углерод проявляет разную валентность - CH4 (IV); C2H6 (III); C6H6 (I)
·
существуют вещества с разными свойствами, но с одинаковым составом молекулы
– формуле C6H12O6 соответствует состав глюкозы
и фруктозы.
·
органических веществ около 25 млн., а неорганических не
достигает и 1 млн.
·
Атомы в
молекулах соединены друг с другом в определённом порядке, согласно их
валентностям (C(IV), O(II), S(II), N(III)),
·
Порядок
соединения атомов – химическое строение.
·
Свойства
веществ зависят не только от их качественного и количественного состава, но и от
химического строения
·
Явление существования
веществ с одинаковым качественным и количественным составом, но разным
химическим строением, называется изомерией, а веществаизомерами.
·
Атомы и
группы атомов в молекуле взаимно влияют друг на друга.
Значение теории – предсказание
свойств по строению, возможность систематизации соединений, предсказание и
синтез новых соединений.
6. Многообразие органических
соединений объясняется:
·
Углеродные
атомы соединяются друг с другом одинарными и кратными связями, образуя прямые,
разветвлённые, замкнутые цепи.
·
Гомология.
·
Существование явления изомерии.
Изомеры - вещества с одинаковым строением
молекулы, но разными химическим строением и свойствами.
Виды изомерии
I. Структурная – заключается в различной последовательности соединения
атомов в цепи молекулы:
1) Изомерия цепи
Следует отметить, что атомы углерода
в разветвленной цепи различаются типом соединения с другими углеродными
атомами. Так, атом углерода, связанный только с одном другим углеродным атомом,
называется первичным, с двумя другими атомами углерода –вторичным,
с тремя – третичным, с четырьмя – четвертичным.
2) Изомерия
положения
·
положения
кратных связей
·
положения
функциональных групп
3) Изомерия межклассовая
4) Таутомерия
Таутомери́я (от греч. ταύτίς — тот
же самый и μέρος —
мера) — явление обратимой изомерии, при которой два или более изомера легко
переходят друг в друга. При этом устанавливается таутомерное равновесие, и
вещество одновременно содержит молекулы всех изомеров в определённом
соотношении. Чаще всего при таутомеризации происходит перемещение
атомов водорода от одного атома в молекуле к другому и обратно в одном и том же
соединении.
Пример, таутомерные формы глюкозы:
1. Линейная
форма глюкозы (альдегидоспирт)
2. Перегруппировка
атомов и переход в циклические формы глюкозы (alha и beta)
II. Пространственная (стерео) –
обусловлена различным положением атомов или групп относительно двойной связи
или цикла, исключающих свободное вращение соединённых атомов углерода.
1. Геометрическая
(цис -, транс – изомерия)
Если атом углерода в молекуле связан
с четырьмя различными атомами или атомными группами, например:
то возможно существование двух соединений с одинаковой
структурной формулой, но отличающихся пространственным строением. Молекулы
таких соединений относятся друг к другу как предмет и его зеркальное
изображение и являются пространственными изомерами.
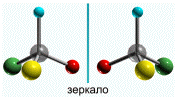
Изомерия этого вида называется оптической, изомеры –
оптическими изомерами или оптическими антиподами:
Молекулы оптических изомеров несовместимы в
пространстве (как левая и правая руки), в них отсутствует плоскость симметрии.
Таким образом,
Таким образом,
·
оптическими изомерами называются пространственные изомеры, молекулы которых относятся между
собой как предмет и несовместимое с ним зеркальное изображение.
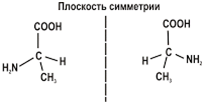
Оптические
изомеры аминокислоты
3. Конформационная
изомерия
Следует
отметить, что атомы и группы атомов, связанные друг с другом σ -связью,
постоянно вращаются относительно оси связи, занимая различное положение в
пространстве друг относительно друга.
Молекулы,
имеющие одинаковое строение и различающиеся пространственным расположением
атомов в результате вращения вокруг С–С связей, называются конформерами.
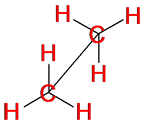
Для
изображения конформационных изомеров удобно пользоваться формулами – проекциями
Ньюмена:
Явление
конформационной изомерии можно рассмотреть и на примере циклоалканов. Так, для
циклогексана характерны конформеры:
Строение атома углерода
Очевидно, что все реакции, в которые вступают
органические молекулы, связаны со строением атома углерода конкретной молекулы
и перестройкой его внешних валентных орбиталей в процессе превращений.
В невозбужденном состоянии атом углерода имеет 2 электрона
на s-орбитали второго подуровня (2s-орбитали), а также 2 электрона на двух (из
всего 3) p-орбиталей 2 подуровня (2px- и 2py-орбиталях):
2s
|
2px
|
2py
|
2pz
|
↑↓
|
↑
|
↑
|
В результате получения энергии извне атом
углерода переходит в возбужденное состояние, когда один из 2s-электронов
переходит на энергетически более высокую 2р-орбиталь:
2s
|
2px
|
2py
|
2pz
|
↑
|
↑
|
↑
|
↑
|
Таким образом, на внешних орбиталях у
углерода имеется 4 электрона, способных к образованию связей. Согласно теории,
формы s- и р-орбиталей описывают вероятность нахождения электрона относительно
ядра атома. Негибридизованные s- и р-орбитали имеют формы сферы и равномерной
«гантели» и располагаются в пространстве согласно нижеприведенной схеме:
При образовании
соединений из атомарного углерода (или в составе соединений углерода)
происходит изменение формы и расположения в пространстве относительно ядра
атома внешних орбиталей углерода, называемое гибридизацией. Схематически
гибридизацию можно представить таким образом:
Из четырех негибридизованных атомных s- и
р-орбиталей, имеющих разную форму, в результате sp3-гибридизации (что
означает изменение одной s- и трех р-орбиталей)
получаются четыре равноценных по энергии и форме гибридизованные молекулярные
орбитали, имеющие форму искаженной гантели.
Для обеспечения минимальных стерических затруднений и
взаимного отталкивания эти четыре равноценные орбитали расположены в
пространстве на равных друг от друга расстояниях, направлены к вершинам
тетраэдра (ядро атома углерода располагается в центре тетраэдра), а
пространственные углы между орбиталями составляют около 109°28’:
В таком состоянии четыре связи в
результате перекрывания орбиталей могут быть образованы беспрепятственно. В
такой гибридизации углерод присутствует (исключительно) в составе алканов,
циклоалканов и спиртов.
Таким образом, например, выглядит молекула
этана (желтыми сферами показаны атомы водорода, точнее, их s-орбитали):
Связь между атомами углерода образована
перекрыванием гибридизованных орбиталей. Такие связи называют s-связями
(сигма-связями). Вокруг s-связи возможно вращение фрагментов молекулы.
Атом углерода, имеющий при себе кратную
связь (алкены -С=С-, карбонильные соединения >C=O, карбоновые кислоты и их
производные -СООН, -COOR и т.д.), имеет другую гибридизацию (sp2),
соответственно, форму и расположение в пространстве внешних орбиталей:
В состоянии sp2-гибридизации
при углероде имеется только 3 гибридизованных орбитали (полученные из одной s-
и двух р-орбиталей), которые расположены в одной плоскости под углом 120° между
ними, а четвертая (негибридизованная) р-орбиталь располагается перпендикулярно
этой плоскости. Двойная связь образуется в результатеперекрывания негибридизованных орбиталей между соседними
атомами углерода (или между углеродом и кислородом), на рисунке представлена
молекула этилена (этена):
Связи, образуемые перекрыванием
негибридизованных р-орбиталей, называют p-связями. Таким образом, кратная
(двойная) связь в молекуле этена образована одной сигма- и одной пи-связью.
Вращение фрагментов молекулы вокруг
p-связи по понятным причинам при нормальной температуре невозможно (необходима
дополнительная энергия на разрыв перекрывающихся р-орбиталей), это
обуславливает наличие пространственных (геометрических) изомеров у алкенов, при
наличии некоторых дополнительных условий, о которых будет сказано ниже.
Углерод при тройной связи (в алкинах и
нитрилах) находится в состоянии sp-гибридизации:
Пара гибридизованных орбиталей расположена в линию,
под углом 180° и противоположно направлена. Две негибридизованные р-орбитали,
согласно принципу минимального отталкивания и для минимизации стерических
затруднений, расположены перпендикулярно этой линии и под углом 90° между
собой. Тройная связь в алкинах образуется в результате перекрывания
гибридизованных орбиталей (одна s-связь) и двух негибридизованных р-орбиталей
соседних атомов углерода (две p-связи). Так, например, выглядит модель молекулы
ацетилена (этин):
В результате протекания реакций углерод
способен как менять, так и сохранять состояние своей гибридизации.
Классификация органических
соединений
Углерод
соединяется друг с другом одинарными и кратными связями (двойными и
тройными), образуя прямые, разветвлённые и замкнутые цепи.
А) Прямая
(неразветвлённая) цепь:
CH3 – CH2 – CH2 – CH3
СH2 = CH – CH2 – CH3
CH ≡ C – CH2 –
CH3
CH2 = CH –
CH = CH2
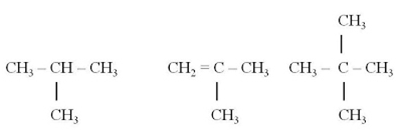
Б) Разветвлённая цепь:
В) Замкнутая
цепь:
К
циклическим относятся карбоциклические
и гетероциклические соединения
– содержащие в цикле кроме атомов углерода атомы других элементов –
кислорода, азота и др.
Функциональные производные углеводородов
( -R или -СnH2n+1) - это
углеводородный радикал, частица, образующаяся при отрыве атома водорода
от молекулы предельного углеводорода (алкана)
Например,
-СН3 метил;
-С2Н5 этил.
|
УПРАЖНЕНИЯ
1. Составить
формулы двух гомологов для вещества, имеющего строение:
Решение:
1. Составляя формулы
гомологов, увеличиваем или уменьшаем число групп СН2 в основной цепи, сохраняя строение
(разветвление).
Приведены два низших
гомолога:
________________________________________________________________
2. В молекуле
одного из алканов находится 34е.
Составьте структурные формулы всех его изомеров.
Решение:
Общая формула
алканов CnH2n+2.
Kоличество
электронов в молекуле заданного алкана: 6n + 2n + 2 = 34. Отсюда n = 4.
Изомеров бутана С4Н10 всего два: н-бутан и 2-метилпропан, CH3CH2CH2CH3 и (CH3)2СНCH3.
________________________________________________________________
3. Приведите
три формулы простых газообразных веществ, которые будут тяжелее второго члена
гомологического ряда алканов, но легче четвертого члена того же ряда.
Решение:
Согласно закону
Авогадро, для газов плотность (г/л) напрямую связана с их молярной
массой
М (г/моль): = М/VM. По условию задачи:
М (г/моль): = М/VM. По условию задачи:
М(С2Н6)
< М (газа – простого в-ва) < М(С4Н10),
или 30 < М (газа) < 58.
Искомые газы – О2,
F2 и Ar.
________________________________________________________________
4. Написать формулы веществ по названиям:
а) 2,3-диметил-5,5-диэтилоктан;
б) 4-изопропилгептан; в) 2,2-диметилпропан; г) неопентан; д) тетраметилметан.
б) 4-изопропилгептан; в) 2,2-диметилпропан; г) неопентан; д) тетраметилметан.
Решение:
Для
того чтобы назвать углеводород по этой номенклатуре, необходимо прежде всего
выбрать углеродный атом, связанный с наибольшим числом других углеродных
атомов, и считать его углеродным атомом метана. Затем надо назвать все
заместители от простого к сложному. Если заместители одинаковые, то перед
названием ставится соответствующее греческое числительное –ди (два), три (три), тетра (четыре). Например, два изомерных
пентана С5Н12:
Формулы веществ а и б:
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Составить структурные формулы соединений,
указать, к какому классу относится каждое из них:
C2H6,
C2H2, CH3OH, C2H5Br, CH3COOH,
C6H6.
2. Написать структурные формулы изомеров
состава C7H12, содержащих один четвертичный атом
углерода, назвать вещества.
3. Привести формулы пяти углеводородов, не
имеющих изомеров.
4. Напишите формулу 2,2,5,5-тетраметилгексана. Приведите формулу его
изомера, в молекуле которого имеются только первичные и вторичные атомы
углерода.
5. Напишите формулу
2,5-диметил-3,4-диэтилгексана. Приведите формулу его изомера, в молекуле
которого содержатся три третичных атома углерода.
6. Укажите, какие из следующих веществ по
отношению друг к другу являются гомологами:
7. Укажите, к какому классу относится каждое
из следующих веществ:
8. Укажите, какие из следующих веществ по
отношению друг к другу являются изомерами и какие – гомологами:
9. Укажите, какие из следующих веществ по
отношению друг к другу являются гомологами:
10. Относительная плотность по водороду
органического вещества равна 15. Определите молекулярную формулу вещества, если
массовые доли углерода, водорода и кислорода равны соответственно 0,4; 0,06;
0,53.
|
1. Наиболее
характерные химические свойства органических соединений в большей степени
определяются:
|
|
|
а) строением углеродной цепи
|
б) числом атомов углерода в цепи
|
|
в) функциональной группой
|
г) ациклическим или карбоциклическим
строением органических соединений
|
|
2.
Какой вид наиболее характерен для органических
веществ:
|
|
|
а) ионные
|
б)
металлические
|
|
в) водородные
|
г) ковалентные
|
|
3.
В каком ряду
все вещества являются между собой гомологами:
|
|
|
а) СН4, С3Н8, С4Н8
|
б) С2Н6, С4Н10, С6Н14
|
|
в) СН4, С4Н10, С7Н8
|
г)
С2Н4, С4Н10, С8Н18
|
|
4.
Укажите величину заряда метильного радикала - СН3:
|
|
|
а) 0
|
б) +1
|
|
в) -1
|
г) -2
|
|
5.
Укажите суммарное число электронов в радикале,
полученном при отрыве атома водорода от молекулы С2Н6:
|
|
|
а) 30
|
б) 29
|
|
в) 17
|
г) 18
|
|
6.
Большинство органических веществ легкоплавки, так
как не имеют кристаллическую решетку:
|
|
|
а) ионную
|
б)
металлическую
|
|
в) атомную
|
г)
молекулярную
|
|
7.
Укажите формулу гомолога вещества состава С6Н6:
|
|
|
а) С6Н12
|
б) С7Н14
|
|
в) С7Н14
|
г) С7Н8
|
|
8.
Для изомеров одинаковы:
|
|
|
а) значения молярных масс
|
б) физические свойства
|
|
в) структурные
формулы молекул
|
г) только
качественный состав
|
|
9.
При симметричном (гомолитическом) разрыве
ковалентной связи образуются:
|
|
|
а) радикал и
катион
|
б) катион и анион
|
|
в) два радикала
|
г) четыре электронейтральные частицы
|
|
10.
Какая группа
атомов не относится к функциональной группе:
|
|
|
а) – NHR
|
б) Cl2
|
|
в) – OH
|
г) – Cl
|
Ответы:
|
1
|
в
|
|
2
|
г
|
|
3
|
б
|
|
4
|
а
|
|
5
|
в
|
|
6
|
г
|
|
7
|
г
|
|
8
|
а
|
|
9
|
в
|
|
10
|
б
|






































Комментариев нет:
Отправить комментарий