9.2.
Электронные эффекты заместителей в органических соединениях
Замещение атомов водорода в молекулах
алканов на любой гетероатом (галоген, азот, серу, кислород и т.д.) или группу
вызывает перераспределение электронной плотности. Природа этого явления
различна. Она зависит от свойств гетероатома (его электроотрицательности) и от
типа связей, по которым это влияние распространяется.
Индуктивный эффект
Если влияние заместителя передается при
участии s-связей, то происходит постепенное изменение электронного состояния
связей. Такая поляризация называется индуктивным эффектом (I),
изображается стрелкой в направлении смещения электронной плотности:
СН3-СН2→Cl,
HO←СН2-СН2→Cl,
СН3-СН2→COOH,
СН3-СН2→NO2 и
т.д.
Индуктивный эффект обусловлен стремлением атома или
группы атомов подавать или оттягивать на себя электронную плотность, в связи с
чем он может быть положительным или отрицательным. Отрицательный индуктивный
эффект проявляют элементы, более электроотрицательные, чем углерод, т.е.
галогены, кислород, азот и другие, а также группы с положительным зарядом на
элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается
справа налево в периоде и сверху вниз в группе периодической системы:
F > O > N,
F > Cl > Br > J.
В случае заместителей с полным зарядом
отрицательный индуктивный эффект увеличивается с возрастанием
электроотрицательности атома, связанного с углеродом:
>O+- >> N+< .
В случае сложных заместителей
отрицательный индуктивный эффект определяется природой атомов, составляющих
заместитель. Кроме этого, индуктивный эффект зависит от характера гибридизации
атомов. Так, электроотрицательность атомов углерода зависит от гибридизации
электронных орбиталей и изменяется в следующем направлении:
sp3 < sp2 < sp.
Положительный индуктивный эффект проявляют
элементы, менее электроотрицательные, чем углерод; группы с полным отрицательным
зарядом; алкильные группы. +I-эффект уменьшается в ряду:
(СН3)3С- > (CH3)2CH- > CH3-CH2-
> CH3- > H-.
Индуктивный эффект заместителя быстро
затухает по мере увеличения длины цепи.
Мезомерный эффект
Наличие заместителя со свободной парой электронов или
вакантной р-орбиталью, присоединенного к системе, содержащей p-электроны,
приводит к возможности смешения р-орбиталей заместителя (занятых или вакантных)
с p-орбиталями и перераспределению электронной плотности в соединениях. Такой
эффект называется мезомерным.
Смещение электронной плотности обычно незначительно и
длины связей практически не меняются. О незначительном смещении электронной
плотности судят по дипольным моментам, которые даже в случае больших эффектов
сопряжения на крайних атомах сопряженной системы невелики.
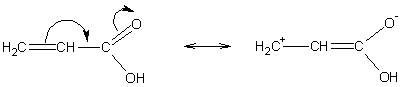
Мезомерный эффект изображают изогнутой стрелкой,
направленной в сторону смещения электронной плотности:
В зависимости от направления смещения
электронного облака мезомерный эффект может быть положительным (+М):
и отрицательным (-М):
Положительный мезомерный эффект (+М)
уменьшается при увеличении электроотрицательности атома, несущего неподеленную
пару электронов, вследствие снижения тенденции отдавать ее, а также при увеличении
объема атома. Положительный мезомерный эффект галогенов изменяется в следующем
направлении:
F > Cl > Br > J (+M-эффект).
Положительным мезомерным эффектом обладают
группировки с неподеленными парами электронов на атоме, присоединенном к сопряженной пи-системе:
-NH2 (NHR, NR2) > OH (OR)
> X (галоген) (+М-эффект).
Положительный мезомерный эффект
уменьшается в том случае, если атом связан с группой-акцептором электронов:
-NH2 > -NH-CO-CH3.
Отрицательный мезомерный эффект возрастает
с увеличением электроотрицательности атома и достигает максимальных значений,
если атом-акцептор несет заряд:
>C=O+H >> >C=O.
Уменьшение отрицательного мезомерного
эффекта наблюдается в случае, если группа- акцептор сопряжена с донорной
группой:
-CO-O- << -СО-NH2 < -CO-OR < -CO-H(R)
<< -CO-CO- < -CO-X (галоген) (–М-эффект).
Гиперконъюгация или
сверхсопряжение
Эффект, подобный положительному
мезомерному, возникает при замещении водорода у кратной связи алкильной
группой. Этот эффект направлен в сторону кратной связи и называется
гиперконъюгацией (сверхсопряжением):
Эффект напоминает положительный
мезомерный, поскольку отдает электроны в сопряженную p-систему:
Сверхсопряжение
уменьшается в последовательности:
СН3 > CH3-CH2 > (CH3)2CH
> (CH3)3C.
Для проявления эффекта гиперконъюгации
необходимо наличие хотя бы одного атома водорода при атоме углерода,
соседствующем с p- системой. Трет-бутильная группировка не проявляет этого
эффекта, а потому мезомерный эффект ее равен нулю.
Электронная природа химических связей в
органических соединениях
1. Все
органические вещества содержат углерод. В молекулах органических веществ
углерод переходит в возбуждённое состояние:
2.
Органическим соединениям свойственны ковалентные связи. Ковалентная связь в
молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной
направленностью.
а) Из курса
химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания
электронных облаков, при этом выделяется энергия, чем больше
перекрывание, тем больше выделяется энергии и тем прочнее связь.
Типы
перекрываний электронных облаков в порядке возрастания их прочности и энергии
выделяемой при образовании:
σ(s – s) < σ(s – p) < σ (p – p)
б) Длина связи
определяется расстоянием между центрами ядер связывающихся атомов и измеряется
в нанометрах (1 нм = 10-9 м). С повышением кратности связи
(одинарная, двойная, тройная) длина становится меньше, а энергия выше:
(С –
С) < (C = C) < (C ≡ C)
в) Под насыщаемостью связи
понимают способность образовывать строго определённое количество ковалентных
связей.
г) Направленность ковалентной
связи определяется взаимным расположением электронных облаков, участвующих в
образовании химической связи. Ковалентная связь образуется в направлении
максимального перекрывания электронных орбиталей взаимодействующих
атомов.
Вы уже
знаете, что атом углерода содержит на внешнем уровне четыре валентных
электрона:
1 электрон
на s – орбитали сферической формы
3 электрона
на трёх p – орбиталях, орбитали имеют форму гантели и
расположены под углом 90˚.
Таким
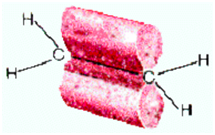
образом можно предположить, что в молекуле метана CH4 атом углерода не может
образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода
имеет 1 электрон на s – орбитали сферической формы). Однако
экспериментально доказано, что в молекуле метана все связи С – Н равноценны и
направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г.
американский учёный Л. Полинг доказал, что в молекуле метана в момент
образования молекулы электронные облака смешиваются и образуют гибридные
электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по
энергии, орбиталей данного атома, с возникновением того же числа
новых гибридных орбиталей, одинаковых по форме и энергии.
В
зависимости от числа вступивших в гибридизацию орбиталей атом углерода может
находиться в одном их трёх состояний гибридизации: sp3, sp2, sp.
sp3 –
гибридизация: происходит смешение одной s и трёх p орбиталей.
Образуются четыре одинаковые гибридные орбитали, расположенные относительно
друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Строение молекулы метана СН4 (тетраэдрическое)
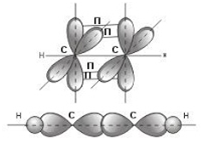
sp2 –
гибридизация: происходит смешение одной s и двух p орбиталей.
Образуются три одинаковые гибридные орбитали, они расположены относительно друг
друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам
треугольника. Образуются 3 ковалентные σ – связи.
Оставшаяся
одна негибридизованная орбиталь расположена перпендикулярно плоскости
образования σ – связей и участвует в образовании П -
связи.
Строение молекулы этилена С2Н4 (плоское
тригональное)
sp –
гибридизация: происходит смешение одной s и одной p орбитали.
Образуются две одинаковые гибридные орбитали, они расположены относительно друг
друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи.
Оставшиеся
две негибридизованные орбитали расположены во взаимно
перпендикулярных плоскостях и образуют две П -
связи.
Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а
следовательно, и геометрическое строение молекул зависят от типа
гибридизации. На форму молекулы в пространстве
влияет направленность только σ – связей.
Способы разрыва связей в молекулах
органических веществ и механизмы органических реакций
Разрыв ковалентной связи может
происходить двумя способами.
1. Разрыв
связи, при котором каждый атом получает по одному электрону из общей пары,
называется гомолитическим:
Например,
CH4 свет→ CH3∙ + ∙H
Cl2 свет→ Cl∙ + ∙Cl
В результате гомолитического разрыва
образуются сходные по электронному строению частицы, каждая из которых имеет
неспаренный электрон. Такие частицы называются свободными радикалами.
Радикал – свободный атом или частица с
неспаренными электронами, неустойчив и способный быстро вступать в химическую
реакцию.
Гомолитический разрыв сопровождает
процессы, осуществляемые при высоких температурах; на свету; при радиоактивном
облучении в отсутствие растворителя (в газовой фазе) или неполярных
растворителях. Гомолитическому разрыву подвергаются малополярные или неполярные
связи C-C, C-H, Cl-Cl и др.
2. Если
при разрыве связи общая электронная пара остается у одного атома, то такой
разрыв называется гетеролитическим:
А+ -
электрофильная частица, :В- - нуклеофильная частица
Например,
CH3Сl → CH3+ + :Cl-
В результате образуются разноименно
заряженные ионы - катион и анион. Если заряд иона
сосредоточен на атоме углерода, то катион называют карбокатионом, а
анион - карбанионом.
Карбокатион
Карбоанион
Устойчивы более разветвлённые
катионы!
Ионный тип разрыва связи характерен
для П- связей и полярных σ – связей; при
наличии полярного растворителя или катализатора.
Классификация органических
реакций
I. Классификация по механизму реакции
В
зависимости от способа разрыва ковалентной связи в реагирующей молекуле
органические реакции подразделяются на радикальные и ионные
реакции.
1. Гомолитические (радикальные) реакции
Например, галогенирование алканов (реакция цепная)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия)
;
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
Внимание! В реакциях замещения алканов легче всего замещаются атомы водорода у
третичных атомов углерода, затем у вторичных и, в последнюю очередь, у
первичных.
2. Гетеролитические (ионные)
Гетеролитический
распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов)
и электрофилов (катионов):
а)
б) H2O → H+ + OH-
Образовавшиеся
ионы вступают в дальнейшие превращения, например:
CH3+ + OH- → CH3OH
электрофил нуклеофил
Ионные
реакции делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Электрофил E (любящий
электроны) – это частица, которая
атакует атом углерода органического соединения, отнимая у него электронную пару
(является акцептором электронов). Примеры частиц – электрофилов: H3O+, H+, HCl, HNO3, NO2+, AlCl3 и
др
Нуклеофил N (любящий ядро) – это частица, которая
атакует атом углерода, предоставляя ему электронную пару (является донором
электронов). Такие частицы, как правило, обладают основными свойствами. К ним
относятся: OH-, Cl-, S2-, NH3, H2O, R-OH, CH3O- и
др
Нуклеофильные
реакции – это
реакции органических веществ с нуклеофилами, т.е. анионами или молекулами,
которые предоставляют электронную пару на образование новой связи:
СH3Br(субстрат) + NaOH(реагент-нуклеофил) → CH3OH + NaBr
Электрофильные
реакции –
реакции органических соединений с электрофильными реагентами, т.е. катионами
или молекулами, которые имеют свободную орбиталь, готовые принять электронную
пару для образования новой связи
C6H6 (субстрат) + HO:- NO2+(реагент –электрофил) → C6H5–NO2 + H – OH
II. Классификация по
направлению и конечному результату химического превращения
Это реакции замещения, присоединения,
отщепления (элиминирования), перегруппировки, окисления и восстановления
Реакции замещения - замена атомов водорода
или группы атомов на другой атом или группу атомов.
Реакции присоединения - введение
атома или группы атомов в молекулу непредельного соединения, что сопровождается
разрывом в этом соединении π – связей.
Реакции отщепления (элиминирование) - реакции, в ходе
которых происходит отщепление атомов или групп атомов от молекулы
органического соединения с образование кратной связи.
Реакции изомеризации (перегруппировка) - реакции с изменением
строения вещества, но с сохранением химического состава.
УПРАЖНЕНИЯ
1. Для атома
углерода в органических
соединениях характерны степени окисления от -4 до +4.
Решение:
С-4H4C-3H3 – C-3H3
C-2H2=C-2H2
C-1H ≡ C –1H
________________________________________________________________
2. Укажите степени окисления всех элементов в CH3CH2OH.
Решение:
Нахождение степеней окисления в органических
соединениях имеет свою специфику. В частности, необходимо отдельно находить
степени окисления для каждого атома углерода. Рассуждать можно следующим
образом. Рассмотрим, например, атом углерода в составе метильной группы (СН3 –) . Данный атом С соединен с 3 атомами водорода
и соседним атомом углерода. По связи С-Н происходит смещение электронной
плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если
бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом
С в составе группы -СН2ОН связан с двумя атомами водорода (смещение
электронной плотности в сторону С), одним атомом кислорода (смещение
электронной плотности в сторону О) и одним атомом углерода (можно считать, что
смещения эл. плотности в этом случае не происходит). Степень окисления углерода
равна -2 +1 +0 = -1.
Ответ:
С-3H+13C-1H+12O-2H+1.
________________________________________________________________
3. Расположите в порядке увеличения скорости
реакции с бромом следующие вещества: этилен, хлорэтилен, пропилен, бутен-1,
бутен-2.
Решение:
Все эти вещества имеют двойную связь и
будут давать реакцию с бромом. Но в зависимости от того, где расположена
двойная связь и какие заместители влияют на сдвиг электронной плотности,
скорость реакции будет разная. Рассмотрим все эти вещества как производные
этилена:
Хлор обладает отрицательным индукционным
эффектом – оттягивает на себя электронную плотность с двойной связи и поэтому
уменьшает ее реакционную способность.
Три вещества имеют алкильные заместители,
обладающие положительным индукционным эффектом, и поэтому имеют бо'льшую, чем
этилен, реакционную способность. Положительный эффект этильной и двух метильных
групп больше, чем одной метильной, следовательно, и реакционная способность
бутена-2 и бутена-1 больше, чем пропена.
Бутен-2 – симметричная молекула, и двойная
связь С–С неполярна. В бутене-1 связь поляризована, поэтому в целом это
соединение более реакционноспособно.
Эти вещества в порядке увеличения скорости
реакции с бромом располагаются в следующий ряд:
хлорэтен < этилен < пропилен <
бутен-2 < бутен-1.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какие
типы эффекторов заместителей существуют.
2. Что
такое индуктивный эффект.
3. Какие
заместители проявляют положительный индуктивный эффект, а какие –
отрицательный.
4. Как
изменяется индуктивный эффект по мере удаления от заместителя.
5. Какие
системы называются сопряженными.
6. Что
такое мезомерный эффект.
7. Какие
заместители проявляют +М, а какие –М эффект.
8. Как
изменяется мезомерный эффект по мере удаления от заместителя.
9. Назовите
примеры заместителей, которые смещают электронную плотность по индуктивному и
мезомерному эффектам в разных направлениях.
10.
Какие
электронные эффекты (индуктивный, мезомерный или оба вместе) имеют место в
молекуле хлорбензола?



























Комментариев нет:
Отправить комментарий