3.8. Гибридизация орбиталей. Пространственная форма
молекул
Образование одинаковых связей из атомных орбиталей разного вида потребовало введения такого
понятия, как ГИБРИДИЗАЦИЯ (то есть “смешивание”) атомных
орбиталей. Почему это понятие стало необходимо?
Вернемся
к уже знакомой нам молекуле BeCl2. Ее образование вполне понятно из
электронного строения атомов бериллия и хлора, которое изображается формулами
Льюиса:
Электронная
конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами
хлора необходим переход электронов бериллия в возбужденное состояние:
Если
бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а
другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными.
Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены
под углом 180о.
Чтобы
объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия,
при которой одна s-орбиталь и одна p-орбиталь (они обведены овалом на
орбитальной диаграмме) как бы смешиваются и выравниваются по форме и энергии,
давая две одинаковые sp-гибридные орбитали.
Каждая
гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные
орбитали бериллия лежат на одной прямой.
Считается,
что благодаря sp-гибридизации молекула BeCl2 имеет линейную форму и все три ее
атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова
геометрия и у всех других sp-гибридизованных молекул - независимо от элементов,
которые входят в эти молекулы.
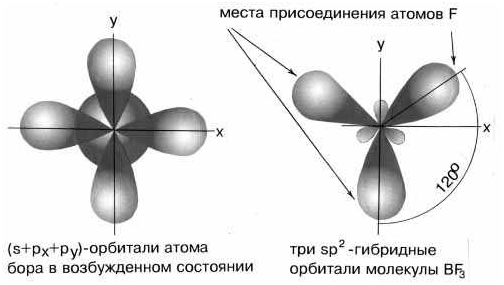
Если
валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизация
орбиталей. Примером может служить sp2-гибридизация бора при
образовании молекулы BF3. На орбитальной диаграмме обведены одна s-
и две p-орбитали, которые “смешиваются”, то есть гибридизуются. Из ОВЭП мы уже
знаем, что sp2-гибридные фрагменты молекул имеют форму плоского
треугольника.
Три
sp2-гибридные орбитали бора лежат в одной плоскости под углом 120o.
Наконец,
когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные
молекулы, имеющие геометрию тетраэдра (рис. 3-9). Примером может служить
молекула метана СН4.
sp3-гибридизация валентных орбиталей
углерода
Четыре
sp3-гибридные орбитали углерода направлены в вершины правильного
тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями
равны и составляют 109°28'.
Существует
важное правило:
При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ
АТОМНЫХ ОРБИТАЛЕЙ.
Если
все гибридные орбитали связаны с одинаковыми атомами, то связи ничем не
отличаются друг от друга. В других случаях встречаются небольшие отклонения от
стандартных валентных углов. Например, в молекуле воды H2O кислород
- sp3-гибридный, находится в центре неправильного тетраэдра, в
вершины которого "смотрят" два атома водорода и две неподеленные пары
электронов (рис. 3-10а). Форма молекулы угловая, если смотреть по центрам
атомов. Валентный угол HОН составляет 105о, что довольно близко к
теоретическому значению 109о.
sp3-гибридизация атомов кислорода и азота в
молекулах а) H2O и б) NCl3
Если
бы не происходило гибридизации (“выравнивания” связей O-H), валентный угол HOH
был бы равен 90°, потому что атомы водорода были бы присоединены к двум взаимно
перпендикулярным р-орбиталям. В этом случае наш мир выглядел бы, вероятно,
совершенно по-другому.
Пространственная
форма молекул
Формулы Льюиса многое говорят об электронном строении
и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической
связи существуют два хороших подхода к объяснению и предсказанию геометрии
молекул. Они хорошо согласуются между собой.
Первый подход называется теорией отталкивания
валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого
подхода очень проста и понятна:
химические связи и неподеленные электронные пары в
молекулах стремятся расположиться как можно дальше друг от друга.
Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be—Cl. Форма этой
молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах
располагались как можно дальше друг от друга:
Это возможно только при линейной форме молекулы, когда
угол между связями (угол ClBeCl) равен 180о.
Другой пример: в молекуле BF3 имеется 3 связи B—F. Они располагаются
как можно дальше друг от друга и молекула имеет форму плоского треугольника,
где все углы между связями (углы FBF) равны 120о :
Еще один пример: в молекуле CH4 имеется 4 связи C—H. Все эти 4 связи расположатся
максимально далеко друг от друга только тогда, когда молекула примет форму
тетраэдра, у которого в центре находится атом C, а в вершинах - атомы H.
Кстати, в "квадратной" молекуле расстояние между атомами водорода
было бы меньше, поэтому реальная молекула CH4 имеет форму тетраэдра:
В молекуле CH4 угол НСН такой же, как в
математическом тетраэдре: 109о28’.
Последний пример: молекула H2O в своем
составе имеет две связи O—H и две неподеленные пары электронов. Вывод:
эта молекула также должна иметь форму, похожую на тетраэдр.
Реально этот тетраэдр слегка искажен, потому что
неподеленные пары отталкиваются между собой несколько сильнее, чем от
поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому
реальный угол HOH составляет не 109о, а немногим менее 105о.
Однако по центрам атомов, как можно видеть, молекула воды имеет угловую форму.
Если ввести обозначения: н.п - неподеленная пара, п.п - поделенная пара, то относительное
отталкивание между ними дает такой ряд:
(н.п/н.п) > (н.п/п.п) > (п.п/п.п).
Теория отталкивания валентных электронных пар (ОВЭП)
проста и наглядна. Она опирается на классическую геометрию и позволяет
правильно предсказывать форму молекул.
УПРАЖНЕНИЯ
1. Какие электроны атомов (например, углерода
или азота) называют неспаренными?
Решение: Электроны, которые
находятся по одному на орбитали, называют неспаренными
электронами. Например, в электронографической формуле возбужденного атома
углерода – четыре неспаренных электрона, а у атома азота – три:
_____________________________________________________________
2. Что означает понятие «общие электронные пары»
в соединениях с ковалентной связью (например, СН4 или Н2S)?
Решение: Два
электрона, участвующие в образовании одной химической связи, называют общей электронной парой. Обычно до
образования химической связи один из электронов этой пары принадлежал одному
атому, а другой электрон – другому атому:
_____________________________________________________________
3.
Какие электронные состояния атомов (например, С или N) называют основными, а какие возбужденными?
Решение:
Электронное состояние атома, в котором соблюдается порядок заполнения
электронных орбиталей: 1s2, 2s2, 2p2, 3s2,
3p2, 4s2, 3d2, 4p2 и т.д., называют основным состоянием. Ввозбужденном состоянии один из валентных электронов атома
занимает свободную орбиталь с более высокой энергией, такой переход
сопровождается разъединением спаренных электронов. Схематически это записывают
так:
Тогда как в основном состоянии было только два
валентных неспаренных электрона, то в возбужденном состоянии таких электронов
становится четыре.
_____________________________________________________________
4. Какие типы гибридизации известны для атома
углерода и в чем они заключаются?
Решение: Для атома
углерода известны три типа гибридизации: sp3, sp2 и sp.
Какие химические связи
называют δ и какие π? Укажите δ- и π-связи в соединениях:
_____________________________________________________________
5.
Для атомов
углерода приведенных ниже соединений укажите: а) тип гибридизации; б) типы его
химических связей; в) валентные углы.
Решение:
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какое
геометрическое строение характерно для молекул, которые содержат
sp-гибридизованные атомы.
2. Какова
геометрическая форма молекул типа АВ3, которые содержат sp2-гибридизованный
атом А.
3. Какова
геометрическая форма молекул типа АВ4, которые содержат sp3-гибридизованный
атом А.
4. Назовите
известные вам виды пространственного строения молекул. Приведите примеры
молекул.
5. Какие типы
гибридизации являются наиболее важными.
6. Сколько
гибридных орбиталей образуется в результате: sp-, sp2-, sp3-гибридизации.
7. Для атомов
элементов 2-го и 3-го периодов напишите электронные и электронно-графические
формулы внешнего электронного слоя в возможных возбужденных состояниях.
8. Какой тип
гибридизации характерен для кремния в SiCl4. Нарисуйте схему
перекрывания электронных облаков в данной молекуле.
9. Какой тип
гибридизации характерен для кремния в MgBr2.
Нарисуйте схему перекрывания электронных облаков в данной молекуле.
10.
Какие
из следующих молекул являются полярными и какие неполярными, почему:
|
1.
Укажите неполярную
молекулу:
|
|
|
а) HCl
|
б) CF4
|
|
в) NH3
|
г) H2S
|
|
2.
Укажите неполярную
молекулу с ковалентными полярными связями:
|
|
|
а) O2
|
б) CO2
|
|
в) HBr
|
г) CO
|
|
3.
У какой частицы есть
sр3-гибридные орбитали:
|
|
|
а) BH4-
|
б) PCl5
|
|
в) HClO4
|
г) ClF3
|
|
4.
По какому типу гибридизованы
валентные орбитали в молекуле ВеН2:
|
|
|
а) sp
|
б) sp2
|
|
в) sp3
|
г) d2sp3
|
|
5.
Какое свойство не
присуще ковалентной связи:
|
|
|
а) насыщенность
|
б) валентность
|
|
в) направленность
|
г) поляризуемость
|
|
6.
sр3 –гибридизация
атомных орбиталей центрального атома может дать такие геометрические
конфигурации молекул:
|
|
|
а) октаэдр
|
б) тетраэдр
|
|
в) тригональная пирамида
|
г) цилиндр
|
|
7.
Чем оценивается
степень полярности ковалентной связи:
|
|
|
а) разностью электроотрицательностей
|
б) величиной эффективных зарядов
|
|
в) значением электрического момента диполя
|
г) длиной диполя
|
|
8.
Характеристиками
ионной связи являются:
|
|
|
а) насыщаемость
|
б) координационное число
|
|
в) направленность
|
г) разность электроотрицательностей
|
|
9.
Укажите соединение с ионной
связью:
|
|
|
а) PH3
|
б) SiCl4
|
|
в) LiF
|
г) NH3
|
|
10.
У какого
соединения более ярко выражена ковалентная полярная связь:
|
|
|
а) CCl4
|
б) H2O
|
|
в) NaCl
|
г) PCl3
|
Ответы:
|
1
|
б
|
|
2
|
б
|
|
3
|
а
|
|
4
|
а
|
|
5
|
б
|
|
6
|
б
|
|
7
|
а
|
|
8
|
б
|
|
9
|
в
|
|
10
|
б
|



















Комментариев нет:
Отправить комментарий