2.8. Закон
сохранения массы веществ. Химические уравнения
В
1748 г. М.В. Ломоносов и в 1789 г. А. Лавуазье независимо друг от друга открыли
закон сохранения массы веществ в химических реакциях. Этот закон формулируется
так:
Масса всех
веществ, которые вступают в химическую реакцию, равна массе всех продуктов
реакции.
Запишем
схему реакции горения метана СН4
в кислороде О2. В
результате этой реакции образуются углекислый
газ СО2 и вода Н2О:
По
закону сохранения массы:
Сохранение
массы веществ в химических реакциях объясняется тем, что число атомов каждого
элемента до и после реакции не изменяется. В ходе химической реакции происходит
только перегруппировка атомов.
В
реакции в молекулах исходных веществ – СН4
и О2 – атом углерода соединяется с атомами водорода, а атомы кислорода – друг с другом; в молекулах продуктов реакции – СО2 и Н2О – и атом углерода, и атомы водорода соединяются с атомами кислорода.
Легко посчитать, что для сохранения числа атомов каждого элемента в данную
реакцию должны вступать 1 молекула СН4 и 2 молекулы О2, а
в результате реакции должны образоваться 1 молекула СО2 и 2 молекулы
Н2О:
Данное
выражение является уравнением химической реакции, или химическим
уравнением.
Числа
перед формулами веществ в уравнении реакции называются коэффициентами.
Химическое
уравнение – это выражение химической реакции, в котором записаны формулы
исходных веществ (реагентов) и продуктов реакции, а также коэффициенты,
показывающие число молекул каждого вещества.
Если
известна схема реакции, то для составления химического уравнения нужно найти
коэффициенты.
Алгоритм
составления уравнения химической реакции
Составим уравнение химической
реакции взаимодействия фосфора и кислорода
|
1. В левой части уравнения
записываем химические формулы реагентов (веществ, вступающих в реакцию).
Помните! Молекулы большинства простых газообразных веществ двухатомны
– H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак
«+», а затем стрелку:
P + O2 →
|
2. В правой части
(после стрелки) пишем химическую формулу продукта (вещества,
образующегося при взаимодействии). Помните! Химические формулы необходимо
составлять, используя валентности атомов химических элементов:
P + O2 → P2O5
|
3. Согласно закону
сохранения массы веществ число атомов до и после реакции должно быть
одинаковым. Это достигается путём расстановки коэффициентов перед химическими
формулами реагентов и продуктов химической реакции.
4P + 5O2 =
2P2O5
|
Составим,
например, уравнение реакции, которая выражается следующей схемой:
В
левой части схемы атомы водорода и хлора входят
в состав молекулы НСl в соотношении 1:1;
в правой части схемы содержатся 3 атома хлора в составе молекулы АlСl3 и 2 атома водорода в составе молекулы Н2.
Наименьшее общее кратное чисел 3 и 2 равно 6.
Напишем
коэффициент «6» перед формулой НСl, коэффициент «2» - перед формулой АlСl3
и коэффициент «3» - перед формулой Н2:
Так
как теперь в правой части содержится 2 атома алюминия, напишем коэффициент «2» перед формулой Аl в левой части
схемы:
В
результате мы получили уравнение данной реакции. Коэффициенты в химическом
уравнении показывают не только число молекул, но и число молей исходных
веществ и продуктов реакции. Например, уравнение показывает, что в реакцию
вступают 2 моля алюминия Аl и 6 молей
хлороводорода НСl, а в результате
реакции образуются 2 моля хлорида алюминия АlСl3 и 3 моля водорода Н2.
Проверим
выполнение закона сохранения массы для данной реакции:
По
уравнениям реакций можно производить различные расчеты.
УПРАЖНЕНИЯ
1.
_______________________________________________________________
2.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Как формулируется закон сохранения массы веществ.
2.
Чем объясняется сохранение массы
веществ в химических реакциях.
3.
Что такое химическое уравнение.
4.
Как называются числа перед
формулами веществ в химических уравнениях.
5.
Что показывают коэффициенты перед
формулами веществ в уравнении химической реакции.
6.
Составьте уравнения реакций,
которые выражаются следующими схемами:
7.
При взаимодействии аммиака NH3
с металлическим натрием Nа образуется амид натрия NаNH2 и выделяется
водород H2 . Составьте химическое
уравнение данной реакции.
8.
Фосфид кальция Са3Р2
вступает в реакцию с водой, в результате образуются газ фосфин РН3 и
гидроксид кальция Са(ОН)2. Какую массу Са(ОН)2 и какой
объем РН3 можно получить из 9,1 г Са3Р2 .
9.
Сколько граммов сульфида серебра Ag2S можно получить по реакции:
если имеется 10 г серебра и 1 г серы.
Какое вещество содержится в этой смеси в избытке.
10.
Определите массу соли и объем водорода,
которые получаются при взаимодействии 1,5 моль алюминия с избытком серной
кислоты по реакции, выражаемой следующей схемой:

1.
Закон
сохранения массы вещества открыл:
|
|
а) Д.И. Менделеев
|
б) Ч. Дарвин
|
в) М.В. Ломоносов
|
г) И. Ньютон
|
2.
В
соответствии с каким законом составляются уравнения химических реакций:
|
|
а)
Закон сохранения массы вещества
|
б) Закон
постоянства состава вещества
|
в)
Периодический закон
|
г)
Закон динамики
|
3.
Химическим
уравнением называют:
|
|
а) условную
запись состава вещества
|
б) условную запись химической реакции
|
в) запись
условия химической задачи
|
г) нет верного ответа
|
4.
Числа перед формулами веществ в уравнении реакции
называются:
|
|
а) индексами
|
б) цифрами
|
в) все ответы верны
|
г) коэффициентами
|
5.
При разложении 10 г оксида ртути (II) было получено 0,8 г кислорода. Сколько ртути
было получено в результате этой реакции:
|
|
а) 10,8 г
|
б) 10 г
|
в) 9,2 г
|
г) 0,8 г
|
6.
Что показывает химическое
уравнение:
|
|
а)
какие вещества вступают в реакцию
|
б)
какие вещества образуются в результате реакции
|
в)
массу реагирующих веществ и веществ, образующихся в результате химической
реакции
|
г) все ответы верны
|
P + O2 → P2O5
7.
Сумма всех коэффициентов в реакции равна:
|
|
а) 11
|
б) 12
|
в) 10
|
г) 9
|
8.
Сумма всех коэффициентов в реакции Al + HCl → AlCl3 + H2 равна:
|
|
а) 12
|
б) 13
|
в) 15
|
г) 11
|
9.
Что в данной реакции СН4 + 2О2 = СО2
+ 2Н2О будет являться
продуктом реакции:
|
|
а) СН4
|
б) СО2 + 2Н2О
|
в) СН4 + 2О2
|
г) О2
|
10.
Что в данной реакции СН4 + 2О2 = СО2
+ 2Н2О будет являться
исходными веществами:
|
|
а) СН4 + 2О2
|
б) 2Н2О
|
в) СН4
|
г) СО2 + 2Н2О
|
Ответы:
1
|
в
|
2
|
а
|
3
|
б
|
4
|
г
|
5
|
в
|
6
|
г
|
7
|
а
|
8
|
б
|
9
|
б
|
10
|
а
|








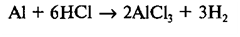










Комментариев нет:
Отправить комментарий