8.2.
Водород, его получение, свойства и применение. Пероксид водорода
Исторические
сведения
Еще в средние века ученый Парацельс заметил, что при действии кислот на
железо выделяются пузырьки какого-то «воздуха». Ломоносов называл его
«горючим паром». Водород открыт в 1766 г. английским физико-химиком Г. Кавендишем
при взаимодействии цинка с кислотами он наблюдал выделение газа, сгорающего на
воздухе с образованием воды.
Кавендиш первым изучил свойства водорода. Он обнаружил, что это необычайно
легкий газ – он в 14 раз легче воздуха. Это свойство водорода позже
использовали для наполнения воздушных шаров и дирижаблей.
Вес водорода Кавендиш вычислил, вычитая из веса колбы с кислотой и цинком
до реакции вес колбы после реакции. А как измерить объем выделившегося газа?
Очень просто: возьмем сосуд с реагентами, выведем из него газоотводную трубку и
накроем сосуд колбой, закрепленной на воде таким образом, чтобы давление в
колбе было равно атмосферному, тогда мы сможем точно определить изменение
объема газа в колбе при неизменном давлении. Разделим изменение веса сосуда до
реакции и после – получим плотность водорода!
Кавендиш, так же, как и многие ученые того времени, считал, что в металлах
присутствует флогистон – особое вещество, необходимое для горения. Полученный
из эксперимента вес водорода не мог быть весом флогистона, ведь флогистон
невесом. Для того, чтобы разрешить это противоречие, Кавендиш предположил, что
водород – это соединение флогистона с кислородом.
Пытаясь удалить флогистон из воздуха, Кавендиш пропустил электрическую
искру через смесь воздуха с водородом, и, к удивлению своему, обнаружил
выделившуюся в результате реакции чистую воду без запаха, которая высыхала, не
оставляя следа. Генри Кавендиш с большой осторожностью делал выводы из своих
экспериментов, и на этот раз он только упомянул о том, что, видимо, опыт может
быть истолкован как доказывающий отсутствие флогистона.
Водород
в природе
|
В рукавах галактики M33 большое количество областей
ионизированного водорода, в которых происходит рождение новых звезд
|
Водород – самый распространенный элемент в космосе (Солнце, большие планеты
Юпитер и Сатурн, звезды, межзвездная среда, туманности); в состав космической
материи входит 63 % H, 36 % He и 1 % всех остальных элементов.
На Земле водород – третий по химической распространенности элемент (после O и
Si), основа гидросферы. Встречается в химически связанном виде (вода, живые
организмы, нефть, природный газ, минералы), содержится в верхних слоях
атмосферы. В атмосфере водорода мало – около 1∙10–5 %, зато в
воде – более 10 %.
Атом водорода наименьший по размерам и самый легкий среди атомов всех
элементов. В природном водороде присутствуют три изотопа: протий
(99,984 %), дейтерий (0,016 %) и тритий, в незначительном количестве
образующийся в верхних слоях атмосферы (на Земле всего 2 кг трития). У обычного
водорода (протия) – самый простой атом, состоящий из одного протона и одного
электрона, с электронной формулой 1s1.
Физические
свойства водорода
Водород Н2 – это бесцветный газ, без запаха и вкуса,
устойчив к нагреванию до 2000 °С. Практически не растворяется в воде.
Водород переходит в жидкое состояние при очень низкой температуре:
–252,87 °С и кристаллизуется при –259,19 °С.
Жидкий водород – самая легкая жидкость (плотность 0,067 г/см3 при
температуре –250 °С), а твердый водород – самое легкое твердое вещество
(плотность 0,076 г/см3). Примечательным свойством водорода
является его способность растворяться в некоторых металлах (например, в платине
и палладии). Так, 1 объем палладия может поглотить до 850 объемов
водорода!
Химические свойства водорода
При
обычных условиях молекулярный Водород сравнительно мало активен,
непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а
на свету и с хлором). Однако при нагревании он вступает в реакции со многими
элементами.
Водород вступает в
реакции с простыми и сложными веществами:
-
Взаимодействие водорода с металлами приводит к
образованию сложных веществ - гидридов, в химических формулах которых атом
металла всегда стоит на первом месте:
При высокой температуре Водород
непосредственно реагирует с некоторыми металлами (щелочными,
щелочноземельными и другими), образуя белые кристаллические вещества
- гидриды металлов (LiН, NaН, КН, СаН2 и
др.):
Н2 + 2Li = 2LiH
Гидриды металлов легко разлагаются
водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 +
2Н2↑
-
При взаимодействии водорода с неметаллами образуются
летучие водородные соединения. В химической формуле летучего водородного
соединения, атом водорода может стоять как на первом так и на втором месте, в
зависимости от местонахождения в ПСХЭ:
1). С кислородом Водород
образует воду:
2Н2 + О2 = 2Н2О
+ Q
При обычных температурах реакция
протекает крайне медленно, выше 550°С - со взрывом(смесь 2 объемов Н2 и
1 объема О2 называется гремучим газом).
2). С галогенами Водород
образует галогеноводороды, например:
Н2 + Cl2 =
2НСl
При этом с фтором Водород взрывается
(даже в темноте и при - 252°С), с хлором и бромом реагирует лишь при освещении
или нагревании, а с йодом только при нагревании.
3). С азотом Водород
взаимодействует с образованием аммиака:
ЗН2 + N2 =
2NН3
лишь на катализаторе и при
повышенных температуpax и давлениях.
4). При нагревании Водород энергично
реагирует с серой:
Н2 + S = H2S
(сероводород),
значительно труднее с селеном и
теллуром.
5). С чистым углеродом Водород
может реагировать без катализатора только при высоких температуpax:
2Н2 + С (аморфный) =
СН4 (метан)
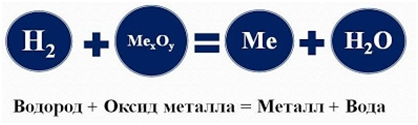
- Водород вступает в
реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и
восстанавливается металл. Водород - проявляет свойства восстановителя:
Водород используется для
восстановления многих металлов, так как отнимает кислород у их оксидов:
Fe3O4 +
4H2 = 3Fe + 4Н2О, и т. д.
Применение водорода
В настоящее время водород получают в
огромных количествах. Очень большую часть его используют при синтезе аммиака,
гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме
того, водород применяют для синтеза соляной кислоты, метилового спирта,
синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп
накаливания и драгоценных камней. В продажу водород поступает в баллонах под
давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью "Водород".
Водород
используется для превращения жидких жиров в твердые (гидрогенизация),
производства жидкого топлива гидрогенизацией углей и мазута. В металлургии
водород используют как восстановитель оксидов или хлоридов для получения
металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена,
вольфрама и др.).
Практическое
применение водорода многообразно: им обычно заполняют шары-зонды, в химической
промышленности он служит сырьём для получения многих весьма важных продуктов
(аммиака и др.), в пищевой - для выработки из растительных масел твёрдых жиров
и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в
кислороде, используется для плавления тугоплавких металлов, кварца и т. п.
Жидкий водород является одним из наиболее эффективных реактивных топлив.
Ежегодное мировое потребление водорода превышает 1 млн. т.
Получение
водорода
Генри Кавендиш впервые получил водород взаимодействием разбавленных серной
и соляной кислот с металлами цинком, железом и оловом:
|
|
|
|
|
|
Получение водорода в промышленности ведут электролизом воды или водных
растворов солей, например, хлорида натрия. Кроме того, в промышленных масштабах
получают так называемый «водяной газ» – смесь водорода и монооксида углерода.
Для этого водяной пар пропускают через колонну с раскаленным углеродом
(коксом). Водород получают также взаимодействием природного газа (метана) с
водой при высокой температуре.
В лаборатории для получения водорода используют взаимодействие разбавленных
кислот (серной, соляной) с цинком (уравнение реакции см. выше), алюминия с
растворами щелочей:
|
или реакции натрия и гидрида кальция с
водой:
|
|
Пероксид
(перекись) водорода
Кроме
воды, известно другое соединение водорода с кислородом - пероксид водорода (Н2О2).
В природе он образуется как побочный продукт при окислении многих веществ
кислородом воздуха. Следы его постоянно содержатся в атмосферных осадках.
Пероксид водорода частично образуется также в пламени горящего водорода, но при
остывании продуктов сгорания разлагается.
В довольно больших
концентрациях (до нескольких процентах) Н2О2 может быть получена взаимодействием водорода в момент выделения с молекулярным кислородом. Пероксид водорода
частично образуется также при нагревании до 2000 °С влажного кислорода, при
прохождении тихого электрического разряда сквозь влажную смесь водорода с
кислородом и при действии на воду ультрафиолетовых лучей или озона.
Физические свойства
Чистый пероксид водорода - бесцветная
сиропообразная жидкость (с плотностью около 1,5 г/мл), под достаточно
уменьшенным давлением перегоняющуюся без разложения. Замерзание Н2О2
сопровождается сжатием (в отличие от воды). Белые кристаллы пероксида водорода
плавятся при -0,5 °С, т. е. почти при той же температуре, что и лёд.
Теплота плавления пероксида
водорода составляет 13 кДж/моль, теплота испарения - 50 кДж/моль (при 25 °С).
Под обычным давлением чистый Н2О2 кипит при
152 °С с сильным разложением (причём пары могут быть взрывоопасны). Для его
критических температуры и давления теоретически рассчитаны значения 458 °С и
214 атм. Плотность чистого Н2О2 равна 1,71
г/см3 в твёрдом состоянии, 1,47 г/см3 при 0 °С и 1,44 г/см3 при 25 °С. Жидкий
пероксид водорода, подобно воде, сильно ассоциирована. Показатель
преломления Н2О2 (1,41), а также её вязкость
и поверхностное натяжение несколько выше, чем у воды (при той же температуре).
Химические свойства
Чем
чище пероксид водорода, тем медленнее она разлагается при хранении. Особенно
активными катализаторами разложения Н2О2
являются соединения некоторых металлов (Сu, Fe, Mn и др.), причём заметно
действуют даже такие их следы, которые не поддаются прямому аналитическому
определению. Для связывания этил металлов к пероксиду водорода в качестве
"стабилизатора" часто добавляют немного (порядка 1:10 000)
пирофосфата натрия - Na4P2O7.
Сама по себе щелочная Среда не вызывает разложения пероксида водорода, но
сильно способствует её каталитическому распаду. Напротив, кислотная среда этот
распад затрудняет. Поэтому раствор Н2О2 часто
подкисляют серной или фосфорной кислотой. Разложение пероксида водорода идёт
быстрее при нагревании и на свету, поэтому хранить его следует в тёмном
прохладном месте.
Подобно воде, пероксид водорода хорошо растворяет многие соли. С водой (также
со спиртом) она смешивается в любых соотношениях. Разбавленный его раствор
имеет неприятный "металлический" вкус. При действии на кожу крепких
растворов получаются ожоги, причём обожженное место окрашивается в белый цвет.
Ниже сопоставлена растворимость некоторых солей в воде и пероксиде водорода при
0 °С (г на 100 г растворителя):
КСl
|
NaCl
|
NaNO3
|
Na2SO4
|
K2SO4
|
|
Н2О
|
28,2
|
35,6
|
73,3
|
4,9
|
7,3
|
Н2О2
|
63,3
|
20,5
|
30,9
|
26,7
|
96,1
|
Из
приведённых примеров видно, что при переходе от Н2О к Н2О2 происходит не простое смещение растворимости в ту или
иную сторону, а проявляется его сильная зависимость от химической природы
солей.
Несмотря на большое сходство пероксида водорода с водой по составу и ряду
свойств, смеси их замерзают при гораздо более низкой температуре, чем каждое
вещество в отдельности. Существуют смеси замерзающие лишь ниже -50 °С. При
таких условиях может образоваться очень нестойкое соединений состава Н2О2·2Н2О.
Следует отметить, что содержащие более 50% Н2О2
водные растворы (равно как и безводный пероксид водорода) весьма склонны к
переохлаждению. С эфиром пероксид водорода, подобно воде, смешивается лишь
ограничено.
Пероксид водорода является сильным окислителем, т. е. легко отдаёт свой лишний
(по сравнению с более устойчивым соединением - водой) атом кислорода. Так, при
действии безводной и даже высококонцентрированной Н2О2
на бумагу, опилки и другие горючие вещества они воспламеняются. Практическое
применение пероксида водорода основано главным образом на его окисляющем
действии. Ежегодное мировое производство Н2О2
превышает 100 тыс. т.
Характерный для пероксида водорода окислительный распад может быть схематически
изображён так:
Н2О2 = Н2О + О (на
окисление)
Кислая среда более благоприятствует этому распаду, чем щелочная.
Значительно
менее характерен для пероксида водорода восстановительный распад по схеме:
Н2О2 = О2 + 2 Н (на восстановление)
Щелочная Среда более благоприятствует такому распаду, чем кислая.
Восстановительный распад пероксида водорода имеет место, например, в
присутствии оксида серебра:
Ag2O + Н2О2 = 2 Ag + H2O + O2
Аналогично, по существу, протекает его взаимодействие с озоном (О3 + Н2О2 = 2 Н2О + 2 О2) и с
перманганатом калия в кислой среде:
2 КMnO4 + 5 Н2О2 + 3 H2SO4 = K2SO4 + 2 MnSO4 + 5 O2 + 8 H2O
Последняя реакция применяется для количественного
определения пероксида водорода.
Пероксид водорода обладает очень слабо выраженными кислотными свойствами. При
её взаимодействии с гидроксидами некоторых металлов образуются соответствующие
пероксиды, которые следует рассматривать как соли пероксида водорода. Так идёт
реакция, например, с гидроксидом бария:
Ва(ОН)2 + Н2О2 = ВаО2 + 2 Н2О
Соли пероксида водорода характеризуются наличием в молекулах пероксидной
цепочки из двух атомов кислорода. У нормальных оксидов подобные цепочки не
имеется. Например:
Na-O-O-Na и О=С=О
В связи с этим отношение пероксидов и нормальных оксидов к кислотам различно -
первые реагируют с образованием пероксида водорода, а вторые дают воду:
ВаО2 + Н2SO4 = BaSO4 + Н2О2
SnO2 + 2 H2SO4 = Sn(SO4)2 + 2 H2O
Путём изучения продуктов реакции с кислотами можно,
таким образом, установить, является ли данное кислородное соединение пероксидом
или оксидом.
Водородные атомы пероксида водорода могут быть замещены не только на металл, но
и на некоторые радикалы кислотного характера. В последнем случае получаются
кислоты, содержащие в составе молекулы пероксидную цепочку и называемые
надкислотами. Они являются, следовательно, производными пероксида водорода (и
подобно последней обладают сильными окислительными свойствами). Примером может
служить надсерная кислота, схематическая формула которой:
НO3S-O-O-SO3H
Соли пероксида водорода являются наиболее обычными представителями пероксидов.
Последние можно в общей формуле определить как химические соединения,
содержащие непосредственно связанные друг с другом атомы кислорода. Обычные
оксиды таких кислород-кислородных мостиков не содержат, чем принципиально и
отличаются от пероксидов.
Сообщалось, что при взаимодействии Н2 и О2 с использованием электрического разряда удалось
получить Н2О3. По данным инфракрасной спектроскопии,
молекула имеет структуру О(ОН)2, причём связи О-О примерно на 5%
длиннее и на 25% слабее, чем в Н2О2. При -60 °С
разложение Н2О3 происходит за
несколько часов на воду и кислород. В обычных условиях этот надпероксид
совершенно неустойчив.
Применение
Более половины всего вырабатываемого пероксида водорода расходуется на отбелку
различных материалов, проводимую обычно в очень разбавленных (0,1-1%) водных
растворов Н2О2. Важное преимущество пероксида
водорода перед другими окислителями заключается в "мягкости"
действия, благодаря чему сам отбеливаемый материал почти не затрагивается. С
этим же связано и медицинское использование очень разбавленных раствором
пероксида водорода в качестве антисептика (для полоскания горла и т. д.).
Очень концентрированные (80% и выше) водные растворы Н2О2
находят применение в качестве источников энергии и самостоятельно (с помощью
катализаторов быстрого разложения Н2О2 из одного литра жидкого пероксида водорода можно
получить около 5000 л нагретой до 700 °С смеси кислорода с водяным паром), и
как окислитель реактивных топлив. Пероксид водорода применяется как окислитель
в химических производствах, как исходное сырьё для получения пероксидных
соединений, инициатор полимеризационных процессов, при изготовлении некоторых
пористых изделий, для искусственного старения вин, крашения волос, вывода пятен
и т. д.
Получение
Пероксид водорода проще всего
получать из пероксида бария (ВаО2), действуя на неё разбавленной серной
кислотой:
ВаО2 + Н2SO4 = BaSO4 + Н2О2
При этом наряду с
пероксидом водорода образуется нерастворимый в воде сульфат бария, от которого
жидкость может быть отделена фильтрованием. Продаётся Н2О2 обычно в виде
3%-ного водного раствора.
Продолжительным
упариванием обычного 3%-ного водного раствора Н2О2 при 60-70 °С можно довести содержание в
нём пероксида водорода до 30%. Для получения более крепких растворов отгонку
воды приходится производить под уменьшенным давлением. Так, при 15 мм рт. ст.
сначала (примерно с 30 °С) отгоняется главным образом вода, а когда температура
достигает 50 °С, в перегонной колбе остаётся очень концентрированный раствор
пероксида водорода, из которого при сильном охлаждении могут быть выделены его
белые кристаллы.
Основным методом
получения пероксида водорода является взаимодействие с водой надсерной кислоты
(или некоторых её солей), легко протекающее по схеме:
Н2S2O8 + 2 H2O = 2 H2SO4 + Н2О2
Меньшее значение имеют
некоторые новые методы (разложение органических пероксидных соединений и др.) и
старый способ получения из ВаО2. Для хранения и перевозки больших
количеств пероксида водорода наиболее пригодны ёмкости из алюминия (не ниже
99,6%-ной чистоты).
УПРАЖНЕНИЯ
1. Рассчитайте объем
водорода (н.у.), который выделится в результате реакции 10 г алюминия с 25 мл
0,8М раствора соляной кислоты.
Решение:
Запишем уравнение реакции:
2Al + 6HCl = 2AlCl3 + 3H2 ↑
n(Al)= m (Al)/ M (Al) = 10/27 = 0,37 моль
n(HCl) = Cm * V = 0,025 * 0,8 = 0,02 моль
По уравнению реакции:
n(HCl) = 3n(Al)
В нашем случае, следовательно, алюминий взят в избытке,
расчет делаем по соляной кислоте.
n (H2) = 0,02/2 = 0,01 моль
V(H2)
= 0,01 * 22,4 = 0,224 л.
________________________________________________________________
2. В сосуде,
имеется смесь водорода и хлора. Как изменится давление в сосуде при пропускании
через смесь электрической искры?
Решение:
При пропускании
искры газы реагируют по уравнению:
Н2 + Сl2 = 2НСl.
В результате этой
реакции общее количество молекул в газовой фазе не изменяется, поэтому давление
в сосуде также остается неизменным.
Задача
2. Газ, выделившийся при действии
2,0 г цинка на 18,7 мл 14,6%-ной соляной кислоты (плотность раствора 1,07
г/мл), пропустили при нагревании над 4,0 г оксида меди (II). Чему равна масса
полученной твердой смеси?
Решение. При действии цинка на соляную кислоту выделяется
водород:
Zn + 2НСl = ZnСl2 + Н2↑,
который при
нагревании восстанавливает оксид меди (II) до меди:
СuО + Н2 = Си + Н2О.
Найдем количества
веществ в первой реакции: m(р-ра НСl) = 18,7.1,07 = 20,0 г. m(НСl) = 20,0.0,146 = 2,92 г. v(НСl) = 2,92/36,5 = 0,08 моль. v(Zn) = 2,0/65 = 0,031 моль. Цинк находится в
недостатке, поэтому количество выделившегося водорода равно:v(Н2) =
v(Zn) = 0,031 моль.
Во второй реакции в
недостатке находится водород, поскольку v(СuО) = 4,0/80 = 0,05 моль.
В результате реакции 0,031 моль СuО превратится в
0,031 моль Сu, и потеря массы составит:
m(СuО) — m(Сu) = 0,031.80 — 0,031.64 =
0,50 г.
Масса твердой смеси
СuО с Сu после пропускания водорода составит 4,0-0,5 = 3,5 г.
Ответ. 3,5 г.
________________________________________________________________
3.
Составьте уравнения следующих реакций:
1) FеSО4 + КClO3 + Н2SО4 → …
2) FеSО4 + КClO3 + КОН → …
3) I2 + Ва(ОН)2 → …
4) КВr + КВrО3 + Н2SО4 → …
Решение:
1) СlO3— — сильный окислитель, восстанавливается до
Сl—; Fе2+ — восстановитель, окисляется до Fе3+ (Fе2(SО4)3):
6FеSО4 + КClO3 + 3Н2SО4 = 3Fе2(SО4)3 + КСl + 3Н2О.
2) СlO3— — окислитель, восстанавливается до Сl—, Fе2+ — восстановитель, окисляется в до Fе3+ (Fе(ОН)3):
6FеSО4 + КClO3 + 12КОН + 3Н2О = 6Fе(ОН)3↓ + КСl + 6К2SO4.
3) Как и все галогены (кроме фтора), иод в щелочной среде диспропорционирует:
6I2 + 6Ва(ОН)2 = 5ВаI2 + Ва(IO3)2 + 6Н2О.
4) Бромид-ион — сильный восстановитель и окисляется бромат-ионом в кислой среде до брома:
5КВr + КВrО3 + 3Н2SО4 = 3Вr2 + 3К2SО4 + 3Н2О.
Эта
реакция обратна реакции диспропорционирования галогенов в щелочной среде.
________________________________________________________________
4.После нагревания 22,12 г перманганата калия образовалось
21,16 г твердой смеси. Какой максимальный объем хлора (н.у.) можно получить при
действии на образовавшуюся смесь 36,5%-ной соляной кислоты (плотность 1,18
г/мл). Какой объем кислоты при этом расходуется?
Решение:
При нагревании
перманганат калия разлагается:
0,06
|
t
|
0,03
|
0,03
|
0,03
|
||
2KMnO4
|
=
|
K2MnO4
|
+
|
MnO2
|
+
|
O2↑
|
Масса смеси уменьшается
за счет выделившегося кислорода: v(О2) = m/ М =
(22,12-21,16) / 32 = 0,03 моль. В результате реакции также образовались
0,03 моль К2МnО4, 0,03 моль МnО2 и
израсходовано 0,06 моль КМnО4. Перманганат калия разложился не весь.
После реакции он остался в смеси в количестве v(КMnО4) =
22,12/158 — 0,06 = 0,08 моль.
Все три вещества,
находящиеся в конечной смеси (КМnО4, К2МnО4,
МnО2), — сильные окислители и при нагревании окисляют соляную
кислоту до хлора:
0,08
|
0,64
|
0,2
|
||||||||
2KMnO4
|
+
|
16HCl
|
=
|
5Cl2↑
|
+
|
2KCl
|
+
|
2MnCl2
|
+
|
8H2O
|
0,03
|
0,24
|
0,06
|
||||||||
K2MnO4
|
+
|
8HCl
|
=
|
2Cl2↑
|
+
|
2KCl
|
+
|
MnCl2
|
+
|
4H2O
|
0,03
|
0,12
|
0,03
|
||||||
MnO2
|
+
|
4HCl
|
=
|
Cl2↑
|
+
|
MnCl2
|
+
|
2H2O
|
Общее количество хлора,
который выделился в этих трех реакциях, равно: v(Сl2) = (0,08.5/2)
+ (0,03.2) + 0,03 = 0,29 моль, а объем составляет V(Сl2)
= 0,29.22,4 = 6,50 л.
Количество
израсходованного хлороводорода равно: v(НСl) = (0,08.16/2)
+ (0,03.8) + (0,03.4) = 0,96 моль,
m(НСl) = v.M =
0,96.36,5 = 35,04 г,
m(р-ра НСl)
= m(НСl)/ω(НСl) = 35,04/0,365 = 96,0 г,
V(р-ра НСl) = т/ρ=
96,0/1,18 = 81,4 мл.
Ответ. V(Сl2)
= 6,50 л, V(р-ра НСl) = 81,4 мл.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Приведите примеры образования водорода в результате
реакции: а) разложения; б) замещения.
2. Какова: а) плотность воздуха по
водороду; б) плотность водорода по
воздуху.
3. При растворении в кислоте 2,33 г смеси
железа и цинка было получено 896 мл водорода (н.у.). Сколько граммов железа и
цинка содержалось в смеси.
4. Составьте уравнения реакций
взаимодействия водорода со следующими веществами: F2, Ca, Al2O3,
оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите
типы реакций.
5. Осуществите превращения по схеме:
H2O → H2 → H2S → SO2
6. Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
5. Осуществите превращения по схеме:
H2O → H2 → H2S → SO2
6. Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
7. Сколько граммов цинка нужно взять для реакции с соляной кислотой
HСl, чтобы получить 1,12 л водорода при нормальных условиях?
8. Между собой прореагировали 23 г Na и 1018 мл воды. Сколько
граммов NaOH растворено в 1л полученного раствора? Сколько литров водорода (при
н.у.) выделилось?
9. Сколько литров водорода (при н.у.) теоретически можно получить в
реакции 448 л метана CH4 с перегретым паром? Какой объем занимал водород сразу после
окончания реакции при давлении 1 атм и температуре 1000 оС?
10. В сосуд с водой поместили электроды и некоторое время пропускали
постоянный электрический ток. Масса сосуда уменьшилась на 360 г. Сколько литров
водорода (при н.у.) было получено в процессе электролиза?
ВИДЕО ОПЫТ
1.
Какие свойства объединяют водород и галогены:
|
|
а) число валентных электронов
|
б) число электронов на внешнем
энергетическом уровне
|
в) нет верного ответа
|
г) число электронов, недостающих до
полного завершения внешнего энергетического уровня
|
2.
Охарактеризуйте связь в молекуле водорода:
|
|
а) ковалентная неполярная
|
б) все ответы верны
|
в) σ-типа
|
г) одинарная
|
3.
Укажите формулы соединений, в которых степень
окисления водорода равна -1:
|
|
а) CH4
|
б) Н2О
|
в) SiH4
|
г) NH3
|
4.
Какие свойства проявляет гидрид кальция при
взаимодействии с водой:
|
|
а) окислителя
|
б) нет верного ответа
|
в) ни окислителя, ни восстановителя
|
г) вещества, отдающего электроны
|
5.
Какова общая формула гидридов щелочноземельных
металлов:
|
|
а) МеН
|
б) МеН3
|
в) МеН2
|
г) МеН4
|
6.
В качестве сырья для получения водорода в
промышленности используют:
|
|
а) серную кислоту
|
б) цинк
|
в) кислород
|
г) природный газ
|
7.
Укажите символ металла, которого нужно меньше
всего по массе для получения 1 моль водорода в реакции с соляной кислотой:
|
|
а) Mg
|
б) Zn
|
в) Fe
|
г) Al
|
8.
Катион водорода и гидрид-ион объединяют между собой:
|
|
а) размеры
|
б) число протонов
|
в) число электронов
|
г) способность присоединять электрон
|
9.
Какое вещество не способно окислить водород в
химических реакциях:
|
|
а) хлор
|
б) все ответы верны
|
в) кислород
|
г) углерод
|
10.
Какой объем водорода (л, н.у.) выделится при
взаимодействии 11,2 г железа с избытком воды при температуре 5700С:
|
|
а) 5,97
|
б) 6,72
|
в) 8,96
|
г) 11,95
|
Ответы:
1
|
г
|
2
|
б
|
3
|
в
|
4
|
в
|
5
|
в
|
6
|
г
|
7
|
г
|
8
|
б
|
9
|
б
|
10
|
а
|













1 комментарий:
Водород— один из самых реакционноспособных хим. элементов, непосредственно взаимодействует со мн. металлами и неметаллами, входит в состав мн. неорганических и почти всех органических соединений.
В обычных условиях молекулярный В. малоактивен. Однако при нагревании вступает в реакцию со многими химическими элементами; https://znaesh-kak.com/x/li/h
Отправить комментарий