3.4. Строение электронной оболочки атома.
Заполнение орбиталей электронами. Электронные конфигурации атомов
элементов I- IV периодов
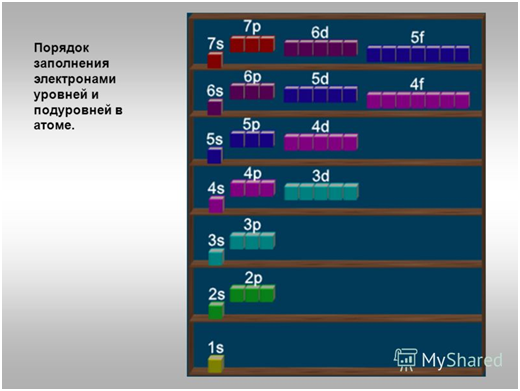
Порядок
заполнения электронами атомных орбиталей определяет принцип наименьшей энергии
( принцип минимума энергии):
Основное (устойчивое) состояние атома – это такое
состояние, которое характеризуется минимальной энергией. Поэтому электроны
заполняют орбитали в порядке увеличения их энергии.
Принцип
наименьшей энергии определяет порядок заполнения энергетических подуровней: электроны
заполняют энергетические подуровни в порядке увеличения их энергии.
Порядок заполнения
уровней и подуровней электронами
I. Электронные формулы
атомов химических элементов составляют в следующем порядке:
·
Сначала по номеру элемента в таблице Д. И.
Менделеева определяют общее число электронов в атоме;
·
Затем по номеру периода, в котором
расположен элемент, определяют число энергетических уровней;
·
Уровни разбивают на подуровни и орбитали,
и заполняют их электронами в соответствии Принципом наименьшей энергии
·
Для удобства электроны можно
распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с
учётом того, что:
1. у элементов главных
подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру
группы.
2. у элементов побочных
подгрупп на внешнем уровне обычно два электрона (исключение
составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем
уровне один электрон, у Pd на внешнем уровне ноль
электронов);
3. число электронов на
предпоследнем уровне равно общему числу электронов в атоме минус число
электронов на всех остальных уровнях.
II. Порядок заполнения
электронами атомных орбиталей определяется:
1.Принципом
наименьшей энергии
Шкала
энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…
2. Состояние атома с
полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали
имеется по одному неспаренному электрону) является более устойчивым.
Этим
объясняется «провал» электрона. Так, устойчивому состоянию атома хрома
соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5, а не 1s22s22p63s23p64s23d4,
т. е. происходит
«провал» электрона с 4s-подуровня на 3d-подуровень.
III. Семейства химических
элементов.
- Элементы, в атомах
которых происходит заполнение электронами s-подуровня внешнего
энергетического уровня, называются s-элементами. Это первые 2
элемента каждого периода, составляющие главные подгруппы I и II
групп.
- Элементы, в атомах
которых электронами заполняется p-подуровень внешнего энергетического
уровня, называются p-элементами. Это последние 6 элементов
каждого периода (за исключением I и VII), составляющие главные
подгруппы III-VIII групп.
- Элементы, в которых
заполняется d-подуровень второго снаружи уровня, называются d-элементами.
Это элементы вставных декад IV, V, VI периодов.
- Элементы, в которых
заполняется f-подуровень третьего снаружи уровня, называются f-элементами.
К f-элементам относятся лантаноиды и актиноиды.
Правило Гунда:
На одном
подуровне электроны располагаются так, чтобы абсолютное значение суммы спиновых
квантовых чисел было максимальным. Это соответствует устойчивому состоянию
атома.
Рассмотрим,
например, какое расположение трех электронов на р-подуровне соответствует устойчивому состоянию атома:
Рассчитаем
абсолютное значение суммарного спина для каждого состояния:
Максимальным
абсолютным значением суммарного спина характеризуются состояния 2 и 5. Поэтому
именно они соответствуют устойчивым
состояниям атома.
Строение электронных оболочек (электронные
конфигурации) атомов элементов I – IV периодов.
Чтобы правильно
изображать электронные конфигурации различных атомов, нужно знать:
1)
Число
электронов в атоме (равно порядковому номеру элемента);
2)
Максимальное
число электронов на уровнях, подуровнях;
3)
Порядок
заполнения подуровней и орбиталей.
Элементы I периода:
Схема
электронного строения атома водорода. (Схемы электронного строения атомов
показывают распределение электронов по энергетическим уровням):
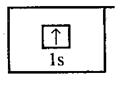
Электронная
формула атома водорода. (Электронные формулы атомов показывают
распределение электронов по энергетическим подуровням):
Электронно-графическая
формула атома водорода. (Электронно-графические формулы атомов
показывают распределение электронов по орбиталям и спины электронов):
УПРАЖНЕНИЯ
1.
Напишите электронную конфигурацию атома
неона в первом возбужденном состоянии.
Решение: Электронная конфигурация атома неона в
основном состоянии – 1s22s22p6. Первое возбужденное состояние получается
при переходе одного электрона с высшей занятой орбитам (2р) на низшую свободную
орбиталь (3s).
Электронная конфигурация атома неона в первом возбужденном состоянии – 1s22s22p53s1.
_____________________________________________________________
2.
Каков состав ядер изотопов 12C и 13C, 14N и 15N.
Решение: Число протонов в ядре равно порядковому
номеру элемента и одинаково для всех изотопов данного элемента. Число нейтронов
равно массовому числу (указываемому слева вверху от номера элемента) за вычетом
числа протонов. Разные изотопы одного и того же элемента имеют разные числа
нейтронов.
Состав указанных ядер:
12С: 6р + 6n; 13С:
6р + 7n; 14N: 7p + 7n; 15N: 7p + 8n.
_____________________________________________________________
3.
Напишите
электронные конфигурации следующих элементов: N, Si, Fе, Кr, Те, W.
Решение: Энергия атомных орбиталей увеличивается в следующем
порядке:
1s2s2p3s3p4s3d4p5s4d5p 6s4f5d6p7s5f6d.
На каждой s-оболочке (одна орбиталь) может находиться не более
двух электронов, на p-оболочке (три орбитали) — не более шести, на d-оболочке (пять орбиталей) — не более 10 и на f-оболочке (семь орбиталей) — не более 14.
В основном состоянии атома электроны занимают
орбитали с наименьшей энергией. Число электронов равно заряду ядра (атом в
целом нейтрален) и порядковому номеру элемента. Например, в атоме азота — 7
электронов, два из которых находятся на 1s-орбитали, два — на 2s-орбитали, и оставшиеся три электрона — на 2p-орбиталях. Электронная конфигурация атома азота:
+7N: 1s22s22p3. Электронные конфигурации остальных элементов:
+14Si: 1s22s22p63s23p2,
+26Fе: 1s22s22p63s23p64s23d6,
+36Кr: 1s22s22p63s23p64s23d103p6,
+52Те: 1s22s22p63s23p64s23d103p65s24d105p4,
+74Те: 1s22s22p63s23p64s23d103p65s24d105p66s24f145d4.
_____________________________________________________________
4.
Какой
инертный газ и ионы каких элементов имеют одинаковую электронную конфигурацию с
частицей, возникающей в результате удаления из атома кальция всех валентных
электронов?
Решение: Электронная оболочка атома кальция имеет
структуру 1s22s22p63s23p64s2. При удалении двух валентных электронов образуется ион Са2+ с конфигурацией 1s22s22р6 Зs2Зр6. Такую же электронную конфигурацию имеют атом Ar и ионы S2-, Сl—, К+, Sc3+и др.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
Напишите электронные
формулы для следующих элементов: 6C, 12Mg, 16S, 21Sc.
2. Элементы имеют следующие электронные
формулы:
а) 1s2 2s2 2p4.
б) 1s2 2s2 2p6 3s2 3p1.
в) 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Какие это элементы? Напишите их латинские символы и названия
на латинском и русском языках.
3. Элемент имеет внешний
электронный уровень такого строения: ...3p3. Что это за элемент?
4. Заполните пропуски в таблице:
Символ
|
168O
|
21D+
|
||||
Число
протонов
|
8
|
14
|
16
|
|||
Число
нейтронов
|
8
|
14
|
14
|
18
|
||
Число
электронов
|
8
|
0
|
10
|
18
|
||
Суммарный
заряд
|
0
|
+1
|
+3
|
0
|
5. Напишите электронную формулу для элемента с зарядом ядра Z =
12.
6. Какие из перечисленных подуровней не
существуют:
2s, 4f, 2p, 3d, 1p, 2d, 1s, 3f ?
7. Какие из перечисленных атомов и ионов
имеют электронные конфигурации, одинаковые с атомом 18Ar:
Ca2+,
Cl-, K, Na+, S2-, As3-, Al3+ ?
8. В каком электронном слое – внешнем или
предвнешнем – происходит увеличение числа электронов в атомах ряда элементов от
21Sc до 30Zn?
9. Сколько электронов находится на внешнем
электронном слое в атомах ряда элементов
от 21Sc до 30Zn?
10. Сколько электронов находится на внешенм
электронном слое в атомах благородных газов.
|
1.
Количество электронов в атоме
равно:
|
|
|
а)
числу протонов
|
б)
числу нейтронов
|
|
в)
числу энергетических уровней
|
г)
относительной атомной массе
|
|
2.
Ион, в составе которого 16
протонов и 18 электронов, имеет заряд:
|
|
|
а)+4
|
б) -2
|
|
в)+2
|
г)-4
|
|
3.
Внешний энергетический уровень
атома элемента, образующего высший оксид состава ЭОз, имеет формулу:
|
|
|
а) ns2np1
|
б) ns2nр2
|
|
в) nз2nр3
|
г) ns2nр4
|
|
4.
Конфигурация внешнего
электронного слоя атома серы в невозбужденном состоянии:
|
|
|
а) 4s2
|
б) 3s23р6
|
|
в) 3s23р4
|
г) 4s24р4
|
|
5.
Электронную
конфигурацию 1s22s22p63s23p64s1 в
основном состоянии имеет атом:
|
|
|
а) лития
|
б) натрия
|
|
в) калия
|
г) кальция
|
|
6.
Восьмиэлектронную внешнюю
оболочку имеет ион:
|
|
|
а) Р3+
|
б) S2-
|
|
в) С15+
|
г) Fe2+
|
|
7.
Двухэлектронную внешнюю
оболочку имеет ион:
|
|
|
а) S6+
|
б) S2-
|
|
в) Вг5+
|
г) Sn4+
|
|
8.
В основном состоянии три
неспаренных электрона имеет атом:
|
|
|
а) кремния
|
б) фосфора
|
|
в) серы
|
г) хлора
|
|
9.
Элемент с электронной
конфигурацией внешнего уровня ... 3s23p3 образует водородное соединение состава:
|
|
|
а) ЭН4
|
б) ЭН
|
|
в) ЭН3
|
г) ЭН2
|
|
10.
Элемент,
которому соответствует высший оксид состава R2O7 имеет электронную
конфигурацию внешнего уровня:
|
|
|
а) ns2np3
|
б) ns2np5
|
|
в) ns2np1
|
г) ns2np2
|
Ответы:
|
1
|
а
|
|
2
|
б
|
|
3
|
г
|
|
4
|
в
|
|
5
|
в
|
|
6
|
б
|
|
7
|
в
|
|
8
|
б
|
|
9
|
в
|
|
10
|
б
|








Комментариев нет:
Отправить комментарий