3.2. Строение атома: физический смысл порядкового
номера элемента, массовые числа атомов, изотопы
В
1913 г. английский физик Г. Мозли установил, что положительный заряд ядра
атома равен порядковому номеру элемента в периодической системе Д. И.
Менделеева.
Каждый
протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является
электронейтральной частицей, поэтому число протонов равно числу электронов.
Следовательно:
Например,
элемент железо имеет порядковый номер 26. Следовательно, заряд ядра
атома железа равен +26, т.е. ядро содержит 26 протонов, а вокруг ядра движутся
26 электронов.
Элементарные
частицы имеют следующие абсолютные и относительные массы:
Данные
этой таблицы показывают, что масса протона, как и масса нейтрона,
приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся
в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса
атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома.
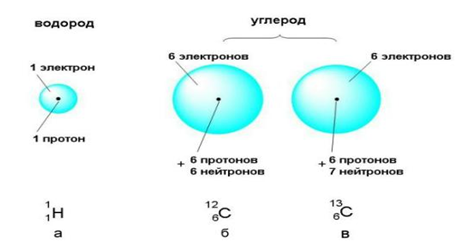
Атомы одного
элемента, которые имеют разные массовые числа, называются изотопами.
Атомы
изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов
(N).
Изотопы
обозначаются символами соответствующих элементов, слева от которых вверху
записывают массовое число изотопа, а внизу – порядковый номер (заряд ядра
атома) элемента. Например:
Элемент
водород
имеет три изотопа, каждый из которых имеет свое название:
В
названиях изотопов других элементов указываются их массовые числа.
Относительная
атомная масса элемента Аr, которая приводится в периодической системе, - это
средняя величина массовых чисел природных изотопов этого элемента с учетом
процентного содержания каждого изопота.
Химические
свойства всех изотопов одного элемента одинаковы. Следовательно, химические
свойства элемента зависят не от атомной массы, а от заряда ядра.
Поэтому
современная формулировка периодического закона читается так:
Свойства элементов
и их соединений находятся в периодической зависимости от заряда ядра атома, или
порядкового номера элемента.
УПРАЖНЕНИЯ
1. Каково
процентное содержание изотопов 35С1
и 37С1 в природном
хлоре, имеющем относительную молекулярную массу 70,90? Предложите способы
выделения чистых веществ 35С12 и 37С12 из природного хлора и его соединений.
Решение: Примем за х процентное содержание изотопа 35Сl:35x +37(100-x) =35,45; x=77,5. Тогда 77,5% 35Сl и 22,5% 37Сl.
Способы разделения изотопов:
- основанные на различии в массе (центрифугирование и т. п.);
- основанные на различном отношении массы к заряду (для ионов, по типу масс-спектрометрии и т. п.);
- основанные на изотопном эффекте в химических процессах (кинетические).
_____________________________________________________________
2. Медь имеет два изотопа с массовыми числами 63 и 65. Массовая доля  их в природной меди составляет соответственно 73% и 27%. На основании
этих данных рассчитайте среднюю относительную атомную массу природной меди.
их в природной меди составляет соответственно 73% и 27%. На основании
этих данных рассчитайте среднюю относительную атомную массу природной меди.
Решение: Пусть m(образца) =
100 г, тогда m(63Cu)
= 73 г; m(65Cu)
= 27 г.
Ответ. 63,54.
_____________________________________________________________
3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Чему
равен заряд ядра и число электронов в атомах следующих элементов: углерод,
сера, медь, барий, серебро.
2. Назовите
элемент, в ядре атома которого содержится 11 протонов.
3. Назовите
элемент, в атоме которого содержится 26 электронов.
4. Напишите
символы изотопов олова, атомы которых содержат 66, 68,
71, 72 нейтрона.
5. Определите
молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода –
дейтерий.
6. Чему
равен порядковый номер элемента, массовое число одного из изотопов которого
равно 31, а число нейтронов равно 16.
7. Сколько
электронов и протонов входит в состав атома элемента, который находится в 5-м
периоде и в побочной подгруппе VI группы.
8. Сколько
электронов и протонов входит в состав атома элемента, который находится в 4-м
периоде и в главной подгруппе III группы.
9. Медь
имеет два изотопа: 63Cu и 65Cu. Молярные доли их в природной меди
составляют 73 и 27% соответственно. Определите среднюю относительную атомную массу меди.
10.
Определите относительную атомную
массу элемента кремния, если он состоит из трех изотопов: 28Si (молярная
доля 92,3%), 29Si (4,7%),
30Si
(3,0%).
|
1.
Чему равно массовое число атома:
|
|
|
а) числу протонов в атоме
|
б) числу нейтронов в атоме
|
|
в)
числу нуклонов в атоме
|
г) числу электронов в атоме
|
|
2.
Чему равно число нейтронов в атоме 15 31Р:
|
|
|
а) 31
|
б) 16
|
|
в) 15
|
г) 46
|
|
3.
Чем отличаются атомы изотопов одного элемента:
|
|
|
а) числом протонов
|
б) числом нейтронов
|
|
в) зарядом ядра
|
г) числом электронов
|
|
4.
Чему равно массовое число атома азота 7N, который содержит 8
нейтронов:
|
|
|
а)14
|
б) 15
|
|
в) 16
|
г) 17
|
|
5.
Зная номер группы, в которой расположен элемент
главной подгруппы, можно предсказать:
|
|
|
а) число энергетических уровней в
атоме
|
б) все ответы верны
|
|
в) общее число электронов
|
г) формулу водородного соединения
|
|
6.
Неверными являются утверждения:
|
|
|
а) все без исключения элементы в
Периодической системе расположены в порядке возрастания относительной атомной
массы
|
б) в четных рядах больших периодов
находятся только металлы
|
|
в) большинство элементов Периодической
системы являются металлами
|
г) в малых периодах расположены
элементы только главных подгрупп, а в больших – как главных, так и побочных
|
|
7.
Формула высшего оксида элемента ЭО2.
Укажите формулу его водородного соединения:
|
|
|
а) ЭН2
|
б) ЭН
|
|
в) ЭН3
|
г) ЭН4
|
|
8.
Укажите физический смысл номера периода:
|
|
|
а) равен числу валентных электронов
|
б) показывает число энергетических
уровней в атоме
|
|
в) равен суммарному числу электронов в
атоме
|
г) равен числу электронов на внешнем
энергетическом уровне
|
|
9.
Укажите группу, в которой приведены символы
сходных по химическим свойствам элементов:
|
|
|
а) Na, Hg, Mg
|
б) S, Mn, Cl
|
|
в) P, As, Sb
|
г) Li, Be, B
|
|
10.
Элементы V-ой группы образуют высшие
оксиды с общей формулой:
|
|
|
а) ЭО3
|
б) Э2О3
|
|
в) Э2О5
|
г) ЭО2
|
Ответы:
|
1
|
в
|
|
2
|
б
|
|
3
|
б
|
|
4
|
б
|
|
5
|
г
|
|
6
|
а
|
|
7
|
г
|
|
8
|
б
|
|
9
|
в
|
|
10
|
в
|










Комментариев нет:
Отправить комментарий