8.9.
Углерод и его важнейшие соединения
Углерод – один из немногочисленных элементов, с которым человек имеет дело с
глубокой древности. Имя первооткрывателя углерода неизвестно, неизвестно и то,
какая из форм углерода была открыта раньше: графит или алмаз. Это открытие
произошло очень давно. Можно лишь утверждать, что до алмаза и графита было
открыто вещество, которое очень долго считали особой модификацией углерода –
это уголь. Название углерода происходит от латинского «карбо» – уголь.
Место
углерода в Периодической системе химических элементов
Д.И. Менделеева
На внешнем энергетическом
уровне атома углерода содержится 4 электрона, которые имеют электронную
конфигурацию 2s22p2. Углерод проявляет степени окисления -4, +2, +4. Углерод – типичный
неметалл, в зависимости от типа превращения элемент может быть окислителем и
восстановителем.
Распространенность в природе
Углерод – довольно распространенный элемент, его содержание в земной коре 0,048
массовых %, его доля в живых организмах значительно выше. В организме человека
массой 70 кг содержится 16 кг углерода. Углерод встречается в свободном
состоянии – в форме графита и алмаза, входит в состав атмосферы в виде
углекислого газа, содержится в природных карбонатах, каменном и буром угле,
нефти и природном газе. Углерод обнаружен в атмосфере Солнца, планет, он найден
в каменных и железных метеоритах. Он является составной частью всех
органических соединений, входит в состав всех живых организмов на Земле, это
элемент жизни.
Аллотропные модификации
углерода
Физические свойства
Имеет четыре основных аллотропных
модификации: алмаз, графит, карбин и фуллерен.
Алмаз – кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень
твёрдое, не проводит электрический ток, плохо проводит тепло,ρ = 3,5 г/см3; Т°пл. = 3730 °C; Т°кип = 4830 °C. В структуре алмаза каждый атом углерода
находится в состоянии sp3-гибридизации и имеет четырех соседей,
которые расположены в вершинах правильного тетраэдра, весь кристалл
представляет собой трехмерный каркас, с этим связана высокая твердость алмаза,
самая высокая среди природных веществ. Кристаллизуется в виде двух полиморфных
модификаций – кубической и гексагональной.
Графит – мягкое вещество серого
цвета со слабым металлическим блеском, жирное на ощупь, проводит электрический
ток; ρ = 2,5 г/см3. Атомы углерода находятся в состоянии sp2-гибридизации и связаны
в плоские слои, состоящие из соединенных ребрами шестиугольников, наподобие
пчелиных сот. Каждый атом в слое имеет трех соседей, для образования трех
ковалентных связей атом предоставляет три электрона, а четвертый электрон
образует p-связь и делокализован по всему кристаллу.
Этим объясняется
способность графита расщепляться на тонкие чешуйки, которые очень прочны, его
металлический блеск, тепло- и электропроводность. Графит – наиболее устойчивая
при комнатной температуре аллотропная модификация углерода.
Карбин – мелкокристаллический порошок серого цвета, ρ = 2 г/см3;
полупроводник. Его кристаллы состоят из линейных цепочек углеродных атомов,
соединенных чередующимися тройными и одинарными связями, или двойными связями,
углерод находится в состоянии sp-гибридизации.
полиин
кумулен
По твердости карбин превосходит графит, но
значительно уступает алмазу. Обладает полупроводниковыми свойствами, образуется
при возгонке графита без доступа воздуха при температуре 2000 °С и низком
давлении.
Фуллерен. Искусственно полученная
модификация углерода, состоящая из молекул C60, C70, …. C1020.
Эти молекулы составлены из атомов углерода, объединенных в пяти и шести
угольники с общими ребрами, получены в 1985 г. За открытие фуллеренов Крото
(Великобритания), Смолли и Керл (США) в 1996 г. получили Нобелевскую премию по
химии. Молекула С60 напоминает футбольный мяч, она состоит из
12 пятиугольников и 20 шестиугольников, каждый атом углерода в молекуле, как в
графите, связан с тремя другими атомами.
Получают фуллерены испарением графита в
атмосфере гелия под действием мощного лазерного излучения или при пропускании
гелия через электрическую дугу между графитовыми электродами. Это черные
вещества с металлическим блеском, обладающие свойствами полупроводников. При
давлении порядка 2·105 атм и комнатной
температуре фуллерен превращается в алмаз. При обычном давлении существует до
1800 °С. В 1992 г. фуллерен обнаружен в природе в минерале шунгите
(аморфном углероде).
Существует еще аморфный углерод – сажа, стеклоуглерод. В них атомы углерода
находятся в различных гибридных состояниях. Стеклоуглерод – уникальный материал
с высокой механической прочностью, электропроводностью, устойчивостью к
агрессивным средам.
При нормальных условиях термодинамически
устойчив только графит, при атмосферном давлении и температуре выше
1000 °С алмаз начинает переходить в графит, выше 2000 °С превращение
происходит за секунды. Жидкий углерод существует только при определенном
внешнем давлении. Переход графита в алмаз происходит при 2800 °С и
давлении 11–12 ГПа.
ХИМИЧЕСКИЕ СВОЙСТВА
УГЛЕРОДА
Углерод -
малоактивен, на холоде реагирует только со фтором; химическая активность
проявляется при высоких температурах.
С – восстановитель
С0 – 4 е-→ С+4 или С0 – 2 е-→ С+2
|
С – окислитель
С0 + 4 е-→ С-4
|
1) с кислородом
C0 + O2 t˚C → CO2 углекислый газ
при недостатке кислорода наблюдается неполное
сгорание образуется угарный газ:
2C0 + O2 t˚C → 2C+2O
2) со фтором
С + 2F2 → CF4
3) с водяным паром
C0 + H2O t˚C → С+2O + H2 водяной
газ
4) с оксидами металлов
С + MexOy = CO2 + Me
C0 + 2CuO t˚C → 2Cu + C+4O2
5) с кислотами –
окислителями:
C0 + 2H2SO4(конц.) → С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O
|
1) с некоторыми металлами
образует карбиды
4Al + 3C0 t˚C → Al4C3-4
Ca + 2C0 t˚C → CaC2-1
2) с водородом
C0 + 2H2 t˚C → CH4
|
Адсорбция
Обратный процесс - выделение этих поглощённых веществ - десорбция.
Применение адсорбции
Очистка от
примесей (в производстве сахара и др.), для защиты органов дыхания
(противогазы), в медицине (таблетки "Карболен") и др.
Применение углерода
Алмазы
широко применяются для резки горных пород и шлифования особо твердых
материалов. Из алмазов при огранке делают ювелирные украшения. Графит применяют
для изготовления инертных электродов и грифелей карандашей. В смеси с
техническими маслами в качестве смазочного материала. Из смеси графита с глиной
изготавливают плавильные тигли. Графит используют в ядерной промышленности, как
поглотитель нейтронов.
Кокс
применяют в металлургии, как восстановитель. Древесный уголь – в кузнечных горнах,
для получения пороха (75%KNO3 + 13%C + 12%S), для поглощения газов (адсорбция), а
также в быту. Сажу применяют, как наполнитель резины, для изготовления черных
красок – типографская краска и тушь, а также в сухих гальванических элементах.
Стеклоуглерод применяют для изготовления аппаратуры для сильно агрессивных
сред, а также в авиации и космонавтике.
Активированный
уголь поглощает вредные вещества из газов и жидкостей: им заполняют
противогазы, очистительные системы, его применяют в медицине при отравлениях.
ДРЕВЕСНЫЙ УГОЛЬ
Древе́сный у́голь — микропористый высокоуглеродистый продукт,
образующийся при разложении древесины без доступа воздуха. Применяется в
производстве кристаллического кремния, сероуглерода, чёрных и цветных металлов,
активированного угля и т. д., а также как бытовое топливо (удельная
теплота сгорания 31,5—34 МДж/кг).
Оксид углерода(II) – СО
(угарный
газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит
голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация
угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная
степень окисления углерода +2 не отражает строение молекулы СО, в которой
помимо двойной связи, образованной обобществлением электронов С и О, имеется
дополнительная, образованная по донорно-акцепторному механизму за счет
неподеленной пары электронов кислорода (изображена стрелкой):
В связи с
этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления
только при высоких температурах. При обычных условиях СО не взаимодействует с
водой, щелочами или кислотами.
Получение:
Основным
антропогенным источником угарного газа CO в настоящее время служат выхлопные
газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании
топлива в двигателях внутреннего сгорания при недостаточных температурах или
плохой настройке системы подачи воздуха (подается недостаточное количество
кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных
условиях, на поверхности Земли, угарный газ CO образуется при неполном
анаэробном разложении органических соединений и при сгорании биомассы, в
основном в ходе лесных и степных пожаров.
1)
В промышленности (в газогенераторах):
C + O2 = CO2 + 402 кДж
CO2 + C = 2CO –
175 кДж
В газогенераторах иногда через
раскалённый уголь продувают водяной пар:
С + Н2О = СО + Н2 – Q,
смесь СО + Н2 – называется синтез – газом.
2)
В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C,
H2SO4 → H2O
+ CO
H2C2O4 t˚C,H2SO4→ CO + CO2 + H2O
Химические
свойства:
При обычных
условиях CO инертен; при нагревании – восстановитель;
CO -
несолеобразующий оксид.
1)
с кислородом
2C+2O + O2 t˚C → 2C+4O2↑
2)
с оксидами металлов CO + MexOy = CO2 + Me
C+2O
+ CuO t˚C → Сu + C+4O2↑
3)
с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)*
реагирует с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние
угарного газа на живые организмы:
Угарный газ
опасен, потому что он лишает возможности кровь нести кислород к жизненно важным
органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином,
который переносит кислород к клеткам организма, в следствии чего тот становится
непригодным для транспортировки кислорода. В зависимости от вдыхаемого
количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые
заболевания и вызывает усталость, головную боль, слабость, Влияние угарного
газа на здоровье человека зависит от его концентрации и времени воздействия на
организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в
течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение
оксида углерода:
Главным
образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый
генераторный или воздушный газ, или же в смеси с водородом водяной газ. В
металлургии для восстановления металлов из их руд. Для получения металлов
высокой чистоты при разложении карбонилов.
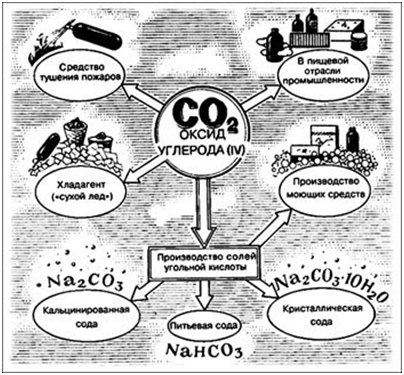
Оксид углерода (IV) СO2 – углекислый газ
Физические свойства: Углекислый
газ, бесцветный, без запаха, растворимость в воде - в 1V H2O
растворяется 0,9V CO2 (при нормальных условиях); тяжелее
воздуха; t°пл.= -78,5°C (твёрдый CO2 называется "сухой лёд");
не поддерживает горение.
Строение молекулы:
Углекислый газ имеет следующие электронную и
структурную формулы -
Все четыре связи ковалентые
полярные.
Получение:
1.
Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO + CO2
2.
Действием сильных кислот на карбонаты и гидрокарбонаты –
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
Способы собирания
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах
(дыхание, гниение, брожение)
Химические свойства:
Кислотный оксид:
1) с водой даёт непрочную угольную кислоту:
СО2 + Н2О ↔ Н2СО3
2) реагирует с основными оксидами и основаниями, образуя соли угольной
кислоты
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3) При повышенной температуре может проявлять окислительные свойства –
окисляет металлы - СO2 + Me = MexOy + C
С+4O2 + 2Mg t˚C→ 2Mg+2O + C0
Качественная
реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка –
нерастворимой соли CaCO3:
Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
Угольная кислота и её соли
Химическая формула - H2CO3
Структурная формула – все связи
ковалентные полярные:
Кислота
слабая, существует только в водном растворе, очень непрочная, разлагается на
углекислый газ и воду:
CO2 + H2O ↔ H2CO3
Химические
свойства:
Для угольной
кислоты характерны все свойства кислот.
1)
Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор
- лакмус краснеет в водном растворе:
H2CO3 ↔ H+ + HCO3-(гидрокарбонат-ион)
HCO3- ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
5) Очень
непрочная кислота – разлагается
Соли угольной кислоты –
карбонаты и гидрокарбонаты
Угольная кислота образует два ряда
солей:
· Средние соли - карбонаты Na2СO3, (NH4)2CO3
· Кислые соли - бикарбонаты,
гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3
мел
мрамор
известняк
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода,
кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические
вещества. Большинство из них в воде не растворяются. Гидрокарбонаты
растворяются в воде.
Химические свойства солей угольной кислоты:
Общие
свойства солей:
1) Вступают
в реакции обмена с другими растворимыми
солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2)
Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3)
Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты
и гидрокарбонаты могут превращаться друг в друга:
Me(HCO3)n + Me(OH)n → MeCO3+H2O
Me(HCO3)n t˚C → MeCO3↓+H2O+CO2↑
карбонаты в гидрокарбонаты
MeCO3+H2O+CO2= Me(HCO3)n
Специфические
свойства:
1) Качественная реакция на CO32- карбонат – ион "вскипание" при
действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Круговорот углерода в
природе
Важную роль в круговороте углерода в
природе играет оксид углерода (IV). Он образуется в результате сжигания нефти и
продуктов её переработки, в результате разложения карбонатов, дыхания животных
и человека. В то же время, углекислый газ поглощается растениями в процессе
фотосинтеза и поглощается природными водами. Схема круговорота углерода в
природе представлена на рисунке:
УПРАЖНЕНИЯ
1. Запишите уравнения реакций, при помощи которых можно осуществить следующие
превращения: С → СH4 → CО → С → СаС2 → С2Н2.
Решение:
Углерод реагирует с водородом в присутствии никелевого
катализатора, образуя метан:
C + 2H2 = CH4.
Оксид углерода (II) образуется при паровой конверсии
метана:
СН4 + Н2О = СО + 3Н2.
Оксид углерода (II) реагирует с водородом с
образованием углерода:
СО + Н2 = С + Н2О.
Карбид кальция получается синтезом из элементов:
Са + 2С = СаС2.
Ацетилен образуется в результате взаимодействия
карбида кальция с водой:
CaC2 + 2H2O = C2H2 + Ca(OH)2.
________________________________________________________________
2. Смесь оксида углерода (II) и метана объемом 29,12 л (н. у.) сожгли, при этом потребовалось 48,16 л (н. у.) кислорода. Вычислите объемные доли газов в исходной смеси.
Решение:
Запишем уравнения реакций горения угарного газа и
метана:
2СО + О2 = 2СО2
(1)
СН4 + 2О2 = СО2 + 2Н2О
(2)
Вычислим количество (в моль) смеси газов:
(моль).
Обозначим количество угарного газа в смеси – х моль, а количество метана – у моль. Тогда общее количество смеси
равно:
х + у = 1,3.
Вычислим количество (в моль) кислорода, затраченного
на сжигание смеси газов:
(моль).
По уравнению (1) соотношение количеств веществ оксида
углерода (II) и кислорода, вступивших в реакцию, равно 2 : 1,
следовательно, количество кислорода, необходимого на реакцию (1), равно 0,5x.
По уравнению (2) соотношение количеств веществ метана и кислорода, вступивших в
реакцию, равно 1 : 2, следовательно, количество кислорода,
необходимого на реакцию (2), равно 2y. По условию задачи количество
затраченного кислорода равно 2,15 моль, поэтому:
0,5х + 2у = 2,15.
Получили систему уравнений с двумя неизвестными:
х + у = 1,3
|
|
0,5х + 2у = 2,15.
|
Решив систему уравнений методом подстановки, найдем
значение у, равное 1 моль; объем метана составляет:
V (CH4) = n (CH4) · Vm = 1 · 22,4 = 22,4 (л).
Тогда объем угарного газа равен:
V (СО) = V (смеси) – V (CH4) = 29,12 – 22,4 =
6,72 (л).
Рассчитаем объемные доли газов в смеси:
(%);
(%).
Ответ: φ(CH4) = 76,9 %, φ(CO) = 23,1 %.
________________________________________________________________
3. При взаимодействии углерода с концентрированной серной кислотой выделилось 13,44 л смеси двух газов (н.у.).Рассчитайте массу углерода, вступившего в реакцию.
Решение:
Пусть в реакцию
С + 2Н2SО4(конц) = СО2↑
+ 2SО2↑ + 2Н2О
вступило х моль С, тогда образовалось х моль СО2 и 2х моль SО2, всего Зх моль газов. По условию, количество газов в смеси
равно13,44/22,4 = 0,6 = Зх, откуда х = 0,2. Масса углерода равна 0,2.12 = 2,4 г.
Ответ. 2,4 г С.
________________________________________________________________
4. При полном гидролизе смеси карбидов кальция
алюминия образуется смесь газов, которая в 1,6 раза легче кислорода.Определите массовые доли карбидов в исходной смеси.
Решение:
В результате гидролиза образуются метан и ацетилен:
Аl4С3 +
12Н2О = 4Аl(ОН)3 + 3СН4↑,
СаС2 +
2Н2О = Са(ОН)2 + С2Н2↑.
Пусть в исходной смеси содержалось х моль Аl4С3 и у моль СаС2, тогда в газовой смеси содержится 3х моль СН4 и у моль С2Н2.Средняя молярная масса газовой смеси равна:
Мср = M(О2) / 1,6 = 20 =
(3x.16 + у.26)
/ (3х+у), откуда у = 2х.
Массовые доли карбидов в исходной смеси равны:
ω(Аl4С3) = 144x / (144х+64у) • 100% = 52,94%,
ω(CаС2)
= 64у / (144х+64у) • 100%
= 47,06%.
Ответ. 52,94% Аl4С3, 47,06% СаС2.
________________________________________________________________
5. При взаимодействии сложного вещества “А” с избытком магния при нагревании образуются два вещества, одно из которых —“В” — под действием соляной кислоты выделяет ядовитый газ “С”. При сжигании газа “С” образуются исходное вещество “А” и вода.Назовите вещества “А”, “В” и “С”. Напишите
уравнения перечисленных химических реакций.
Решение:
Вещество “А” — оксид кремния, SiO2. При взаимодействии SiO2 с магнием сначала образуется кремний, который
реагирует с избытком магния и образует силицид кремния, Mg2Si ( (вещество “В”):
SiO2 + 4Mg = Мg2Si + 2MgО.
Силицид магния легко гидролизуется с образованием ядовитого
газа силана, SiН4 (вещество “С”):
Mg2Si + 4НСl = SiН4↑ + 2MgCl2.
При сгорании силана образуются исходное вещество SiO2 и вода:
SiН4 +
2О2 = SiO2 +
2Н2О.
________________________________________________________________
6. Смесь кремния и угля, массой 5,0 г, обработали избытком концентрированного раствора щелочи при нагревании. В
результате реакции выделилось 2,8 л водорода (н.у.). Вычислите
массовую долю углерода в этой смеси.
Решение:
С раствором щелочи реагирует только кремний:
Si + 2NаОН + Н2О
= Na2SiO3 +
2Н2↑.
v(Н2) = 2,8/22,4 = 0,125 моль. v(Si) = 0,125/2 = 0,0625 моль. m(Si) = 0,025.28 = 1,75 г. m(С)
= 5,0-1,75 = 3,25 г. Массовая доля углерода равна: ω(С) =
3,25/5,0 = 0,65, или 65%.
Ответ. 65% С.
________________________________________________________________
7. При сплавлении гидроксида натрия и оксида кремния (IV) выделилось 4,5 л водяных паров (измерено при 100 °С и 101 кПа).
Какое количество силиката натрия при этом образовалось?
Решение:
При сплавлении происходит реакция:
2NаОН + SiO2 = Na2SiO3 + Н2О↑.
Количество выделившейся воды равно: v(Н2О) = РV / RТ = 101.4,5 / (8,31.373) =
0,147 моль.Количество образовавшегося Na2SiO3 также равно 0,147 моль.
Ответ. 0,147 моль Nа2SiO3.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Закончите
уравнения реакций, составьте электронный баланс, укажите окислитель и
восстановитель для каждой реакции:
С+О2 (изб) =
С+О2 (недост)=
С + H2 =
C + Ca =
C + Al =
2. Составьте уравнения реакций, протекающих при
нагревании угля со следующими оксидами: оксидом железа (III) и оксидом олова
(IV). Составьте электронный баланс для каждой реакции, укажите процессы
окисления и восстановления; окислитель и восстановитель.
3. Закончите уравнения реакций, составьте электронный
баланс для каждой из реакций, укажите процессы окисления и восстановления;
окислитель и восстановитель:
CO2 + C =
C + H 2 O =
С O + O2 =
CO + Al2O3 =
4. Вычислите количество энергии, которое необходимо для
получения 448 л угарного газа согласно термохимическому уравнению
CO2 +
C = 2CO – 175 кДж
5. Закончите уравнения осуществимых химических реакций:
CO 2+ KOH =
CO + Al =
H2CO3+ K2SO4 =
CO2( изб ) + NaOH =
С O2+ Na2O =
CaCO3+ CO2 + H2O =
CO2+ Ca(OH)2 =
CO + CaO =
CO2+ H2SO4 =
Ca(HCO3)2+ Ca(OH)2=
H2CO3+ NaCl =
6. Осуществите превращения по схеме:
1) Al 4 C 3→ CH 4→
CO 2→ CaCO 3→ Ca ( HCO 3)2→
CaCO 3
2) Ca → CaC 2→ Ca ( OH )2→ CaCO 3→
CO 2→ C
3) CO2 → H2CO3 → Na2CO3 →
CO2
7. Какой объём углекислого газа
выделится при обжиге карбоната кальция массой 200 г.
8. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого
газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим.
9. При нагревании 20 г гидрокарбоната
натрия выделилось 2,24 л оксида углерода (IV) при н.у. Какая массовая доля (в %)
гидрокарбоната разложилась.
10. 62,5 г мрамора, содержащего 20%
примесей, обработали избытком соляной кислоты. Образовавшийся газ пропустили
через раскаленный уголь. Какой газ и в каком объеме при этом образуется.
ВИДЕО ОПЫТ
1.
Чем различаются между собой графит и алмаз:
|
|
а) все ответы верны
|
б) твердостью
|
в) электрической проводимостью
|
г) окраской
|
2.
Аллотропными модификациями углерода являются:
|
|
а) графит
|
б) все ответы верны
|
в) карбин
|
г) алмаз
|
3.
Гидрокарбонат натрия можно перевести в карбонат
натрия:
|
|
а) прокаливанием
|
б) взаимодействием с Na
|
в) взаимодействием с соляной кислотой
|
г) с помощью водного раствора
углекислого газа
|
4.
Массовая доля углерода в его оксиде составляет
42,86 %. Валентность углерода в этом оксиде равна:
|
|
а) I
|
б) III
|
в) II
|
г) IV
|
5.
Какие вещества полностью переводят гидрокарбонаты
в карбонаты:
|
|
а) сильные кислоты
|
б) щелочи
|
в) вода
|
г) водный раствор углекислого газа
|
6.
С помощью какого реактива можно различить между
собой находящиеся в разных пробирках растворы Na2CO3 и NaHCO3:
|
|
а) HCl
|
б) KCl
|
в) CaCl2
|
г) KNO3
|
7.
Какой максимальный объем (л, н.у.) CO2
может
поглотить раствор, содержащий 1,85 г Ca(OH)2
(растворимостью СО2 в воде
пренебречь):
|
|
а) 1,12
|
б) 0,56
|
в) 0,28
|
г) 0,84
|
8.
Какое вещество является реактивом на углекислый
газ:
|
|
а) магний
|
б) гидроксид калия
|
в) гидроксид кальция
|
г) вода
|
9.
В лаборатории углекислый газ в основном получают:
|
|
а) сжиганием метана
|
б) взаимодействием мела и соляной
кислоты
|
в) обжигом известняка
|
г) сжиганием угля в избытке кислорода
|
10.
Относительная плотность по водороду смеси СО
и СО2 равна 18. Объемная доля (%) СО2 в газовой смеси
составляет:
|
|
а) 45
|
б) 50
|
в) 55
|
г) 60
|
Ответы:
1
|
а
|
2
|
б
|
3
|
а
|
4
|
б
|
5
|
б
|
6
|
в
|
7
|
а
|
8
|
в
|
9
|
б
|
10
|
б
|






















Комментариев нет:
Отправить комментарий