Раздел 3.1 Периодический закон и периодическая система химических элементов
Д.И. Менделеева. Строение атома. Химическая связь
3.1. Периодический
закон и периодическая система химических элементов Д. И. Менделеева
Периодический
закон – один из важнейших законов химии.
Этот
закон открыл в 1869 г. великий русский ученый-химик Дмитрий Иванович Менделеев.
В
середине XIX в. было известно около 60 химических элементов. Д. И. Менделеев
полагал, что должен существовать закон, который объединяет все химические
элементы. Менделеев считал, что главной характеристикой элемента является
его атомная масса. Поэтому он
расположил все известные элементы в один ряд в порядке увеличения их атомной
массы.
В
ряду от Li до F металлические свойства
элементов ослабляются, а неметаллические свойства усиливаются. Аналогично изменяются
свойства элементов в ряду от Na до Cl.
Такой
характер изменения свойств элементов и их соединений, какой наблюдается при
увеличении атомной массы элементов, называется периодическим изменением. Свойства всех химических элементов при
увеличении атомной массы изменяются периодически.
Это
периодическое изменение называется периодической
зависимостью свойств элементов и их соединений от величины атомной массы.
Поэтому
Д. И. Менделеев сформулировал открытый им закон так:
Свойства
элементов, а также формы и свойства соединений элементов находятся в
периодической зависимости от величины атомной массы элементов.
Менделеев
расположил периоды элементов друг под другом и в результате составил периодическую систему элементов.
Периодическая
система
– это графическое выражение периодического закона. Каждый элемент занимает
определенное место в периодической системе и имеет свой порядковый номер.
Например:
Структура
периодической системы
Периодическая
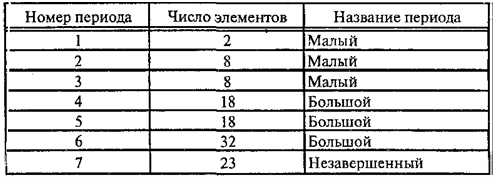
система состоит из семи периодов, десяти рядов и восьми групп.
Период – это
последовательность элементов, которая начинается щелочным металлом и
заканчивается благородным газом.
Исключения: первый период, который начинается водородом; седьмой период, который является
незавершенным.
Периоды
разделяются на малые и большие. Малые периоды состоят из одного горизонтального ряда. Первый,
второй и третий периоды являются малыми. Большие
периоды состоят из двух горизонтальных
рядов. Четвертый, пятый и шестой периоды являются большими. Верхние ряды больших периодов
называются четными, нижние ряды –
нечетными.
В
шестом периоде после лантана находятся
14 элементов, которые похожи по свойствам на лантан и называются лантаноидами.
Они располагаются в нижней части периодической системы.
В
незавершенном седьмом периоде после актиния
находятся 14 элементов, которые похожи по свойствам на актиний и называются актиноидами.
Как и лантаноиды, они располагаются в нижней части периодической системы.
Число элементов в периодах
В каждом периоде
слева направо металлические свойства элементов ослабляются, а неметаллические
свойства усиливаются.
В
четных рядах больших периодов находятся только металлы.
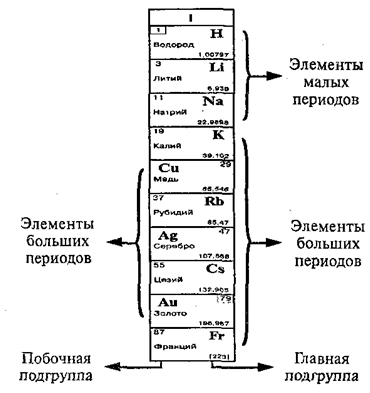
Группа – это
совокупность элементов, которые имеют одинаковую высшую валентность в оксидах и
в других соединениях. Эта валентность равна номеру группы.
Исключения:
Каждая
группа состоит из двух подгрупп: главной и побочной. Главная подгруппа содержит элементы
малых и больших периодов. Побочная
подгруппа содержит элементы только больших периодов.
Например,
рассмотрим 1-ю группу периодической системы:
В главных
подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические
свойства ослабевают. Все элементы побочных подгрупп являются металлами.
УПРАЖНЕНИЯ
1. Приведите современную формулировку периодического закона.
Объясните, почему в периодической системе элементов аргон, помещены
соответственно перед калием, хотя имеют бóльшую атомную массу. Как называются
пары таких элементов?
Решение: Свойства элементов и их соединений находятся в периодической зависимости
от заряда ядра атома, или порядкового номера элемента.
При
увеличении порядкового номера (заряда ядра) в атомах элементов последовательно
увеличивается общее число электронов, а число электронов на внешнем электронном
слое изменяется периодически, что приводит к периодическому изменению свойств
химических элементов.
Положение
элементов в Периодической таблице не зависит от атомной массы
элемента, а зависит от заряда ядра, поэтому Ar+18 помещен перед K+19, Co+27 –
перед Ni +28, Te+52 – перед I+53, Th+90 – перед Pa+91 (хотя аргон, кобальт,
теллур и торий имеют большую массу, чем калий, никель, йод и протактиний соответственно).
Пары
элементов с различным числом протонов и нейтронов, но с одинаковым числом
нуклонов называют изобарами, например
элемент
|
Число протонов
|
Число нейтронов
|
Число
нуклонов
|
Ar
|
18
|
22
|
40
|
K
|
19
|
21
|
40
|
_____________________________________________________________
2. Как изменяются свойства гидроксидов
элементов в периодах и группах с увеличением порядкового номера? Почему?
Решение: Металлы могут образовывать и основные, и кислотные, и
амфотерные гидроксиды. При этом с увеличением степени окисления металла (при
движении слева направо в периодической таблице) основной
характер его оксидов и гидроксидов ослабляется, а кислотный усиливается.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
Сила оснований слева направо уменьшается, а сверху вниз растет, так
же как металлические свойства растут сверху вниз.
Например,
Cs (цезий) более активный металл, чем К (калий), так как у Cs валентный
электрон находится дальше от ядра, чем у К (калия) и Cs легче отдает электрон
(так как притяжение ядра ослабевает).
Если один элемент может иметь разные степени
окисления, то с увеличением степени окисления элемента сила основания
уменьшается, больше проявляется кислотный характер образуемого соединения, например
Cr+2(OH)2
Cr+3(OH)3≡H3CrO3
H2CrO4
основание
амфотерный гидроксид
кислота
основной характер ослабляется, кислотный характер
усиливается
Неметаллы не образуют основные и амфотерные оксиды. Практически
все оксиды неметаллов являются кислотными.
Например,
Na2O – основной оксид, NaOH – основание
SO3 –
кислотный оксид, H2SO4 –
кислота
Al2O3 – амфотерный оксид, может
образовывать, как основание (Al(OH)3), так и кислоту HAlO2 или H3AlO3.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.
В коком периоде, в какой группе и в какой подгруппе
находятся элементы с порядковыми номерами 14, 29, 52, 56, 78.
2.
Напишите символы, названия и порядковые номера всех
элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы.
3.
Какие элементы главной подгруппы пятой группы
являются элементами малых периодов. Напишите их символы, названия, порядковые
номера.
4.
Напишите формулы оксидов элементов с порядковыми
номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
5.
Какой элемент имеет более выраженные металлические
свойства: Са (Z = 20) или Ва
(Z = 56). Почему?
6.
Какой элемент имеет более выраженные неметаллические
свойства: Р (Z = 15) или Cl (Z = 17). Почему?
7.
Какой элемент четвертого периода является самым
активным неметаллом. Почему?
8.
Исходя из положения галлия в периодической системе
элементов Д. И. Менделеева, опишите важнейшие свойства простого вещества и
соединений элемента.
9.
Один из элементов образует оксид, массовая доля
кислорода в котором составляет 0,305. Элемент проявляет в этом оксиде степень окисления, равную + 4. Определите
относительную атомную массу этого элемента и назовите его.
10.
Элемент образует высший оксид состава ЭО3.
С водородом этот же элемент образует летучее соединение, массовая доля водорода
в котором составляет 5,88%. Рассчитайте относительную атомную массу элемента и
назовите его.
|
1. Среди всех элементов главной подгруппы
I группы элемент литий обладает:
|
|
|
а) наиболее выраженными металлическими свойствами
|
б) самой маленькой плотностью
|
|
в) самой большой относительной атомной массой
|
г)
все ответы верны
|
|
2. Гипотетическая формула высшего оксида
115-го элемента периодической системы может иметь вид:
|
|
|
а) ЭО2
|
б) Э2О5
|
|
в) ЭО4
|
г) Э2О11
|
|
3. Порядковый номер элемента с наибольшей
электроотрицательностью в 4 группе периодической системы:
|
|
|
а) 6
|
б)72
|
|
в)82
|
г)12
|
|
4. Сколько энергетических уровней
заполнено электронами в ионе калия:
|
|
|
а) 4
|
б)3
|
|
в)6
|
г)5
|
|
5. При сгорании 1,86 г органического
вещества образовалось 3,96 г углекислого газа и 0,54 г воды. Сколько всего
атомов содержит молекула этого соединения, если известно, что его молярная
масса меньше 200 г/моль:
|
|
|
а) 3
|
б)2
|
|
в)15
|
г)13
|
|
6. В каких рядах химические элементы
перечислены не в порядке уменьшения их атомных радиусов:
|
|
|
а)
все ответы верны
|
б) S,
Cl, Br
|
|
в) Li, Na, K
|
г) B, Be, Li
|
|
7. В порядке возрастания энергии
ионизации расположены следующие элементы:
|
|
|
а) Na, Mg, Al, Si
|
б) Na, Mg, Ca, Si
|
|
в)
все ответы верны
|
г) Si, Al, Mg, Na
|
|
8. По происхождению (этимологии) названий
«лишним» в перечне элементов будет:
|
|
|
а) селен
|
б) теллур
|
|
в) ниобий
|
г) церий
|
|
9. Одинаковое по абсолютной величине, но
разное по знаку значение степени окисления в летучем водородном соединении и
в высшем оксиде имеет элемент:
|
|
|
а) бор
|
б) азот
|
|
в) сера
|
г) углерод
|
|
10.
Свойства
высших оксидов элементов 3-го периода изменяются следующим образом:
|
|
|
а) амфотерные, основные, кислотные
|
б) основные, кислотные, амфотерные
|
|
в) основные, амфотерные, кислотные
|
г) кислотные, амфотерные, основные
|
Ответы:
|
1
|
б
|
|
2
|
б
|
|
3
|
а
|
|
4
|
б
|
|
5
|
г
|
|
6
|
а
|
|
7
|
а
|
|
8
|
в
|
|
9
|
г
|
|
10
|
в
|






1 комментарий:
Фоамирановые цветы своими руками.
адениум семена и взрослые адениумы
Отправить комментарий