3.9. Донорно-акцепторный механизм образования
ковалентной связи. Ионная, металлическая, водородная связи. Межмолекулярные
взаимодействия. Типы кристаллических решеток
Донорно-акцепторный
механизм образования связи
Существует еще один механизм
образования связи. Рассмотрим его на примере взаимодействия молекулы аммиака с
молекулой трифторида бора:
У атома азота в молекуле аммиака после образования связей с атомами
водорода остается еще одна валентная орбиталь с неподеленной парой электронов
(в структурной формуле обозначена точками). У атома бора в молекуле трифторида
бора после образования связей с атомами фтора остается одна свободная валентная
орбиталь (в структурной формуле обозначена • ). Неподеленную пару валентных
электронов атом азота может предоставить атому бора " в совместное
использование" , " поделиться" с ним этой электронной парой. При
этом электроны бывшей неподеленной пары становятся общими для атомов азота и
бора, то есть между ними образуется ковалентная связь. Но при этом у атомов
бора и азота возникают еще и формальные заряды: – 1 е у атома бора и +1 е у
атома азота:
В результате между атомами азота и бора возникает и ковалентная, и ионная
связь. При этом атом азота является донором электронной пары
(" дает" ее для образования связи), а атом бора – акцептором ("
принимает" ее при образовании связи). Отсюда и название механизма
образования такой связи – " донорно-акцепторный" .
Донорно-акцепторный механизм образования связи – механизм образования
связи, при котором один из связываемых атомов является донором электронной
пары, а другой – акцептором.
|
При образовании связи по донорно-акцепторному механизму образуются
одновременно и ковалентная связь, и ионная.
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов.
Конечно, после образования связи за счет разницы в электроотрицательности связываемых атомов происходит поляризация связи, возникают частичные заряды, снижающие эффективные (реальные) заряды атомов.
Рассмотрим другие
примеры.
Если рядом с
молекулой аммиака окажется сильно полярная молекула хлороводорода, в которой на
атоме водорода имеется значительный частичный заряд 
 , то в этом случае
роль акцептора электронной пары будет выполнять атом водорода. Его 1s-АО
хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная
плотность в облаке этой орбитали существенно понижена.
, то в этом случае
роль акцептора электронной пары будет выполнять атом водорода. Его 1s-АО
хоть и не совсем пустая, как у атома бора в предыдущем примере, но электронная
плотность в облаке этой орбитали существенно понижена.
Пространственное
строение получившегося катиона, иона аммония NH4 ,
подобно строению молекулы метана, то есть все четыре связи N—H совершенно
одинаковы.
,
подобно строению молекулы метана, то есть все четыре связи N—H совершенно
одинаковы.
Образование ионных кристаллов хлорида аммония NH4Cl можно наблюдать, смешав газообразный аммиак с газообразным хлороводородом:
Образование ионных кристаллов хлорида аммония NH4Cl можно наблюдать, смешав газообразный аммиак с газообразным хлороводородом:
NH3(г)+
HCl(г) = NH4Cl(кр)
Донором
электронной пары может быть не только атом азота. Им может быть, например, атом
кислорода молекулы воды. С тем же хлороводородом молекула воды будет
взаимодействовать следующим образом:
Образующийся
катион H3O называется ионом оксония и, как вы скоро узнаете, имеет огромное значение в
химии.
называется ионом оксония и, как вы скоро узнаете, имеет огромное значение в
химии.
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида углерода) СО:
В заключение рассмотрим электронное строение молекулы угарного газа (монооксида углерода) СО:
В ней, кроме трех
ковалентных связей (тройной связи), есть еще и ионная связь.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко. Особенно часто он встречается при образовании соединений d-элементов. Атомы почти всех d-элементов имеют много свободных валентных орбиталей. Поэтому они являются активными акцепторами электронных пар.
Условия образования связи по донорно-акцепторному механизму:
1) наличие у одного из атомов неподеленной пары валентных электронов;
2) наличие у другого атома свободной орбитали на валентном подуровне.
Донорно-акцепторный механизм образования связи распространен довольно широко. Особенно часто он встречается при образовании соединений d-элементов. Атомы почти всех d-элементов имеют много свободных валентных орбиталей. Поэтому они являются активными акцепторами электронных пар.
ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ ОБРАЗОВАНИЯ СВЯЗИ, ИОН АММОНИЯ, ИОН ОКСОНИЯ, УСЛОВИЯ ОБРАЗОВАНИЯ
СВЯЗИ ПО ДОНОРНО-АКЦЕПТОРНОМУ МЕХАНИЗМУ.
·
ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные
орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному
электрону:
·
ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов
атома-донора и вакантной орбитали атома-акцептора:
Характеристики ковалентной связи не
зависят от механизма ее образования.
ИОННЫЙ ТИП ХИМИЧЕСКОЙ
СВЯЗИ
Чисто ионной связью называется химически связанное состояние атомов, при
котором устойчивое электронное окружение достигается путём полного перехода
общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
На практике полный переход электрона от одного атома к другому атому-паренеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую, но не нулевую, электроотрицательность, илюбая связь будет в некоторой степени ковалентной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящихся в состоянии разноименно заряженных ионов.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион.
При отдаче или присоединении электронов молекулами образуются молекулярные или многоатомные ионы, например О2+ - катион диоксигенила, NO2--нитрит-ион.
Одноатомные катионы и одноатомные анионы возникают при химической реакции между нейтральнами атомами путем взаимопередачи электронов. При этом атом электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число электроно на внешнем слое , переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов.
Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы-неметаллами. При передаче электронов металлического и неметаллического элементов стремятся сформировать вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает внешнюю оболочку последующего благородного газа, тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую конфигурацию предыдущего благородного газа.
Схема
образования ионной связи
Кулоновские силы притяжения, возникающие при взаимодействии заряженных
ионов, сильные и действуют одинаково во всех направлениях. В результате этого
расположение ионов упорядочивается в пространстве определенным образом, образуя
ионную кристаллическую решётку. Вещества с ионной КР при обычных условиях
находятся в кристаллическом состоянии, они имеют высокие температуры плавления
и кипения.
Вещество
|
NaCl
|
NaOH
|
KBr
|
BaF2
|
BaCl2
|
Свойство
|
|||||
t пл 0С
|
801
|
321
|
734
|
1368
|
961
|
t кип 0С
|
1465
|
1390
|
1380
|
2260
|
2050
|
МЕТАЛЛИЧЕСКИЙ ТИП
ХИМИЧЕСКОЙ СВЯЗИ
Металлы и их сплавы кристаллизуются в форме металлических решёток.
Узлы в металлической решётке заняты положительными ионами металлов. Валентные
электроны, отделившиеся от атомов металлов и оставшиеся в узлах кристаллической
решётки ионы, более или менее свободно перемещаются в пространстве между
катионами и обуславливают электрическую проводимость металлов. Между ионами и
свободными электронами возникают электростатические взаимодействия, которые и
являются причиной возникновения металлической связи.
СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ
Металлическая связь имеет сходство как с ионной (образуется за
счёт взаимодействия между заряженными частицами: электронами и ионами), так и с
ковалентной ( происходит обобществление электронов, но в отличии от ковалентной
связи, где электроны локализованы около определенных атомов, электроны в
металлах обобществляются для всего кристалла). Свободные электроны иногда
называют электронным газом.
Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах.
Катионы в металлических решётках не обладают поступательным движением, а совершают колебания вокруг положения узлов решётки. Амплитуда этих колебаний возрастает при повышении температуры, а при достижении температуры плавления металла решётка разрушается. Температура плавления металлов, как правило возрастает с увеличением числа валентных электронов в их атомах.
ВОДОРОДНЫЙ ТИП ХИМИЧЕСКОЙ СВЯЗИ
ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип
взаимодействия между реакционно-способными группами, при этом одна из групп
содержит атом водорода, склонный к такому взаимодействию. Водородная связь –
глобальное явление, охватывающее всю химию. В отличие от обычных химических
связей, Н-связь появляется не в результате целенаправленного синтеза, а
возникает в подходящих условиях сама и проявляется в виде межмолекулярных или
внутримолекулярных взаимодействий.
Отличительная черта водородной связи
– сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия
химической связи. По энергии она занимает промежуточное положение между
химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что
удерживают молекулы в твердой или жидкой фазе.
Для возникновения водородных связей важно,
чтобы в молекулах вещества были атомы водорода, связанные с небольшими, но
электроотрицательными атомами, например: O, N, F. Это создает заметный
частичный положительный заряд на атомах водорода. С другой стороны, важно,
чтобы у электроотрицательных атомов были неподеленные электронные пары. Когда
обедненный электронами атом водорода одной молекулы (акцептор) взаимодействует
с неподеленной электронной парой на атоме N, O или F другой молекулы (донор),
то возникает связь, похожая на полярную ковалентную.
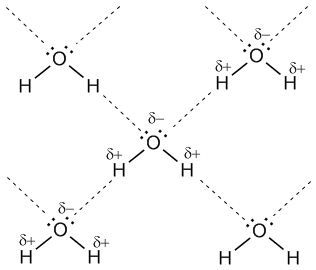
Водородные связи между молекулами воды (обозначены пунктиром)
Объемная модель, показывающая расположение молекул воды, связанных
водородными связями
Учитывая заметную разницу зарядов на
атомах Н и О соседних молекул, дополнительную прочность этой межмолекулярной
связи придает притяжение разноименных зарядов. Водородные связи характерны для
таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
В водных растворах аммиака или HF эти
молекулы образуют водородные связи не только между собой, но и с молекулами
воды. Благодаря водородным связям аммиак NH3 имеет фантастическую растворимость: в
1 л воды может растворяться 750 л газообразного аммиака! В органических
веществах встречаются также внутримолекулярные водородные связи, сильно влияющие на
пространственную форму этих молекул.
Межмолекулярное взаимодействие
Межмолекулярное взаимодействие - взаимодействие молекул между
собой, не приводящее к разрыву или образованию новых химических связей. В их
основе, как и в основе химической связи, лежат электрические взаимодействия.
Силы Ван-дер-Ваальса включают все виды межмолекулярного
притяжения и отталкивания. Они получили название в честь Я.Д. Ван-дер-Ваальса, который первым принял во внимание межмолекулярные взаимодействия для объяснения свойств реальных газов
и жидкостей. Эти силы определяют отличие реальных газов от идеальных,
существование жидкостей и молекулярных кристаллов. От них зависят многие
структурные, спектральные и другие свойства веществ.
Основу ван-дер-ваальсовых сил составляют кулоновские силы
взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами
другой. На определенном расстоянии между молекулами силы притяжения и
отталкивания уравновешивают друг друга, и образуется устойчивая система.
Ван-дер-ваальсовы силы заметно уступают химическому связыванию.
Например, силы, удерживающие атомы хлора в молекуле хлора почти в десять раз
больше, чем силы, связывающие молекулы Cl2 между собой. Но без этого слабого
межмолекулярного притяжения нельзя получить жидкий и твердый хлор.
Ориентационное взаимодействие
Полярные молекулы, в которых центры тяжести положительного и
отрицательного зарядов не совпадают, например HCl, H2O, NH3,
ориентируются таким образом, чтобы рядом находились концы с противоположными
зарядами. Между ними возникает притяжение.
Для взаимодействия двух диполей энергия притяжения между ними
(энергия Кеезома)
выражается соотношением:
EК = −2 μ1 μ2 / 4π ε0 r3,
где μ1 и
μ2 - дипольные моменты
взаимодействующих диполей, r - расстояние между ними. Притяжение
диполь-диполь может осуществляться только тогда, когда энергия притяжения
превышает тепловую энергию молекул; обычно это имеет место в твердых и жидких
веществах. Диполь-дипольное взаимодействие проявляется в полярных жидкостях
(вода, фтороводород).
Индукционное взаимодействие
Если рядом с полярная молекула окажется полярная рядом с
неполярными, она начнет влиять на них. Поляризация нейтральной частицы под действием
внешнего поля (наведение диполя) происходит благодаря наличию у молекул
свойства поляризуемости γ. Постоянный диполь может индуцировать дипольное
распределение зарядов в неполярной молекуле. Под действием заряженных концов
полярной молекулы электронные облака неполярных молекул смещаются в сторону
положительного заряда и подальше от отрицательного. Неполярная молекула
становится полярной, и молекулы начинают притягиваться друг к другу, только
намного слабее, чем две полярные молекулы.
EД = −2 μнав2 γ / r6,
где μнав -
момент наведенного диполя.
Притяжение постоянного и наведенного диполей обычно очень слабое,
поскольку поляризуемость молекул большинства веществ невелика. Оно действует
только на очень малых расстояниях между диполями. Этот вид взаимодействия
проявляется главным образом в растворах полярных соединений в неполярных
растворителях.
Дисперсионное взаимодействие
Между неполярными молекулами также может возникнуть притяжение.
Электроны, которые находятся в постоянном движении, на миг могут оказаться
окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица
станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и
между ними устанавливаются кратковременные связи:
EЛ = −2 μмгн2 γ2 / r6,
где μмгн -
момент мгновенного диполя. Лондоновские силы притяжения между неполярными
частицами (атомами, молекулами) являются весьма короткодействующими. Значения
энергии такого притяжения зависят размеров частиц и числа электронов в
наведенных диполях. Эти связи очень слабые - самые слабые из всех межмолекулярных
взаимодействий. Однако они являются наиболее универсальными, так как возникают
между любыми молекулами.
КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ
Из курса физики вы знаете, что вещества могут существовать в трёх
агрегатных состояниях:твёрдм, жидком, газообразном. В данном параграфе
рассмотрим кристаллические вещества, т.е. вещества, находящиеся в твёрдом
состоянии.
Они образуют кристаллические
решётки.
Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещния частиц называют узлами кристаллической решётки.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, ихарактера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.
Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещния частиц называют узлами кристаллической решётки.
В зависимости от типа частиц, расположенных в узлах кристаллической решётки, ихарактера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.
ИОННЫЕ
|
Ионными называют
кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества
с ионной связью. Ионные кристаллические решётки имеют соли, некоторые оксиды
и гидроксиды металлов.
|
Рассмотрим строение
кристалла поваренной соли, в узлах которого находятся ионы хлора и натрия.
Связи между ионами в
кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой
обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
|
АТОМНЫЕ
|
Атомными называют
кристаллические решётки, в узлах которых находятся отдельные атомы, которые
соединены очень прочными ковалентными связями.Ниже показана кристаллическая
решётка алмаза.
|
В природе встречается
немного веществ с атомной кристаллической решёткой. К ним относятся бор,
кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры
плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный
материал.
|
МОЛЕКУЛЯРНЫЕ
|
Молекулярными называют
кристаллические решётки, в узлах которых располагаются молекулы. Химические
связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах
прочные, но между молекулами связи не прочные. Ниже представлена
кристаллическая решётка I2
|
Вещества с МКР имеют
малую твёрдость, плавятся при низкой температуре, летучие, при обычных
условиях находятся в газообразном или жидком состоянии
|
МЕТАЛЛИЧЕСКИЕ
|
Металлическими
называют решётки, в узлах которых находятся атомы и ионы металла.
|
Для металлов
характерны физические свойства: пластичность, ковкость, металлический блеск,
высокая электро- и теплопроводность.
Типы кристаллических
решеток твердых веществ
|
УПРАЖНЕНИЯ
1.
Металлическая связь имеет
черты сходства с ковалентной связью. Сравните эти химические связи между собой.
Решение: Образование
металлической связи происходит благодаря образованию общего электронного облака
кристалла металла. Образование ковалентной связи* также происходит за счет
обобществления электронов, только не всех, а отдельных, неспаренных. При этом
образуются общие электронные пары.
_____________________________________________________________
2.
По формулам веществ
определите тип химической связи в них: Ва, ВаВг2, НВг, Вг2.
Решение: Ва —
металл, связь металлическая
ВаВr2 — соль, связь ионная (образована
металлом и неметаллом)
НВr — газ,
вещество молекулярного строения, связь ковалентная полярная (образована двумя
разными неметаллами)
Вr2 — жидкость, вещество молекулярного
строения, связь ковалентная неполярная (образована двумя одинаковыми атомами
атомами неметалла).
_____________________________________________________________
3.
Из
приведенных ниже веществ атомную кристалличекую решетку имеет:
1. Магний
2. Сера
3. Нафталин
4. Алмаз
Решение: Магний – это металл. Он имеет металлическую кристаллическую
решетку. Сера, нафталин – молекулярную кристаллическую решетку.
Правильный
ответ 4.
_____________________________________________________________
4.
В
узлах кристаллических решеток веществ молекулярного строения находятся:
1. Молекулы
2. Атомы
3. Атомы и ионы
4. Молекулы и ионы
Решение: В узлах
кристаллических решеток веществ молекулярного строения находятся
молекулы.
Правильный
ответ 1.
_____________________________________________________________
5.
Кристаллическая решетка графита:
1. атомная
2. молекулярная
3. ионная
4. металлическая
Решение: Графит
образован углеродом – неметаллом. Значит, кристаллическая решетка
не может быть ионной, металлической или молекулярной.
Правильный
ответ 1.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1.
Составьте уравнения реакций и схемы образования
а) бромида аммония NH4Br из аммиака и бромоводорода;
б) сульфата аммония (NH4)2SO4 из аммиака и серной кислоты.
а) бромида аммония NH4Br из аммиака и бромоводорода;
б) сульфата аммония (NH4)2SO4 из аммиака и серной кислоты.
2.
Напишите
молекулярные формулы следующих соединений:
3. Какое из двух соединений
ковалентное, а какое - полярное ковалентное: F-F, Cl-F ?
4. Какова прочность связи
между частицами кристаллов в молекулярной, ионной, атомной и металлической
кристаллических решетках.
5. Назовите известные вам
виды межмолекулярного взаимодействия.
6. Какие частицы находятся в
узлах молекулярной, ионной, атомной и металлической кристаллических решеток.
7. Приведите примеры
веществ, которые в твердом состоянии имеют молекулярную, ионную, атомную и
металлическую кристаллические решетки.
8. Какие их следующих
веществ являются ионными соединениями:
Почему? Напишите схемы образования этих соединений.
9. Отличаются ли свойства донорно-акцепторной связи от
свойств обычной ковалентной связи.
10.
|
1.
Какие связи присутствуют в NH4Cl:
|
|
|
а) ковалентные неполярные
|
б) водородные
|
|
в) ковалентные полярные
|
г) металлические
|
|
2.
Какая связь возникает при взаимодействии между
собой атомов элементов с конфигурацией валентных электронов …3d54s2 и 3d64s2:
|
|
|
а) ионная
|
б) ковалентная полярная
|
|
в) водородная
|
г) металлическая
|
|
3.
Вещества с какими типами химических связей могут
образовывать молекулярную кристаллическую решетку:
|
|
|
а) ковалентной полярной
|
б) ионной
|
|
в) водородной
|
г) металлической
|
|
4.
Укажите формулы веществ с ионной связью:
|
|
|
а) КОН
|
б) все ответы верны
|
|
в) К2SO4
|
г) KF
|
|
5.
В каком ряду названы вещества с атомной,
молекулярной и ионной кристаллическими решетками в твердом состоянии:
|
|
|
а) алмаз, хлорид натрия, графит
|
б) белый фосфор, вода, водород
|
|
в) оксид кремния (IV), медь, азот
|
г) алмаз, фтор, фторид калия
|
|
6.
Укажите формулы молекул или ионов, в которых
присутствуют ковалентные связи, образованные по донорно-акцепторному
механизму:
|
|
|
а) СО
|
б) все ответы верны
|
|
в) NH4 +
|
г) H3O+
|
|
7.
Охарактеризуйте свойства вещества с молекулярной
кристаллической решеткой:
|
|
|
а) легкоплавкое
|
б) растворимое
|
|
в) хорошо проводит электрический ток
|
г) тугоплавкое
|
|
8.
Охарактеризуйте строение иона аммония и химические
связи в нем:
|
|
|
а) валентность атома азота равна IV
|
б) степень окисления атома азота равна
-3
|
|
в) все ответы верны
|
г) все связи ковалентные полярные
|
|
9.
Между элементами с атомными номерами 3 и 9
возникает связь:
|
|
|
а) ковалентная
|
б) ионная
|
|
в) металлическая
|
г) водородная
|
|
10.
Сколько
валентных электронов атомов азота и водорода в сумме участвуют в образовании
химической связи в молекуле аммиака:
|
|
|
а) 10
|
б) 6
|
|
в) 7
|
г) 3
|
Ответы:
|
1
|
в
|
|
2
|
г
|
|
3
|
а
|
|
4
|
б
|
|
5
|
г
|
|
6
|
б
|
|
7
|
а
|
|
8
|
в
|
|
9
|
б
|
|
10
|
б
|











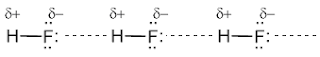











Комментариев нет:
Отправить комментарий