8.6.
Общая характеристика элементов подгруппы азота. Азот. Аммиак. Соли
аммония
Общая характеристика химических элементов
подгруппы азота
Подгруппа азота (пниктогены)
– V группа, главная подгруппа «А» - азот, фосфор, мышьяк, сурьма,
висмут.
НАХОЖДЕНИЕ В ПРИРОДЕ
Содержание
в земной коре: азот - 0,01%, фосфор - 0,08%, мышьяк - 0,0006%, сурьма -
0,0004%, висмут - 0,00002%.
Каждый из элементов имеет электронную конфигурацию на внешнем
уровне ns2nр3 и может проявлять в своих
соединениях степень окисления от -3 до +5. Азот и фосфор — типичные неметаллы,
мышьяк проявляет и металлические свойства, сурьма и висмут — типичные металлы.
В отличие от всех других, вV группе периодической системы очень
резко изменяются свойства составляющих ее элементов.
Свойства элементов V-A подгруппы
Элемент
|
Азот
N |
Фосфор
Р |
Мышьяк
As |
Сурьма
Sb |
Висмут
Bi |
Свойство
|
|||||
Порядковый номер элемента
|
7
|
15
|
33
|
51
|
83
|
Относительная атомная масса
|
14,007
|
30,974
|
74,922
|
121,75
|
208,980
|
Температура плавления,С0
|
-210
|
44,1
(белый) |
817
(4МПа) |
631
|
271
|
Температура кипения,С0
|
-196
|
280
(белый) |
613
|
1380
|
1560
|
Плотность г/см3
|
0,96
(твёрдый) |
1,82
(белый) |
5,72
|
6,68
|
9,80
|
Степени окисления
|
+5, +3,-3
|
+5, +3,-3
|
+5, +3,-3
|
+5, +3,-3
|
+5, +3,-3
|
Подгруппу
азота составляют пять элементов: азот, фосфор, мышьяк, сурьма и висмут. Это
р-элементы V группы периодической системы Д. И. Менделеева.
На наружном энергетическом уровне атомы этих элементов содержат пять электронов, которые имеют конфигурацию ns2np3 и распределены следующим образом:
На наружном энергетическом уровне атомы этих элементов содержат пять электронов, которые имеют конфигурацию ns2np3 и распределены следующим образом:
Поэтому
высшая степень окисления этих элементов +5, низшая -3, характерна и +3.
Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней — 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.
Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней — 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.
внешняя электронная оболочка фосфора (невозбужденный атом)
внешняя электронная оболочка возбужденного атома фосфора
Таким образом, фосфор, мышьяк, сурьма и висмут в возбужденном состоянии имеют 5 неспаренных электронов, и валентность их в этом состоянии равна 5.
В атоме азота возбудить электрон подобным образом нельзя вследствие отсутствия d-подуровня на втором уровне. Следовательно, пятивалентным азот быть не может, однако он может образовать четвертую ковалентную связь по донорно-акцепторному механизму за счет неподеленной электронной пары 2s2. Для атома азота возможен и другой процесс. При отрыве одного из двух 2s-электронов азот переходит в однозарядный четырехвалентный ион N+.
Таблица. Электронное
строение и физические свойства
Поряд-
ковый № |
Элемент
|
Относит.
атомная масса |
Электронная
конфигурация |
Атомный
радиус, нм |
ПИ
эВ |
ЭО
|
Степени
окисления |
t°пл.
°С |
t°кип.
°С |
r
г/см3 |
7
|
Азот (N)
|
14,01
|
[He] 2s22p3
|
0,075
|
14,5
|
3,0
|
-3, -2,
-1, +1,
+2, +3, +4, +5 |
-210
|
-196
|
|
15
|
Фосфор (P)
|
30,97
|
[Ne] 3s23p3
|
0,110
|
10,5
|
2,1
|
-3, +1,
+3, +5
|
44,1
|
280
|
1,83
|
33
|
Мышьяк (As)
|
74,92
|
[Ar] 3d104s24p3
|
0,121
|
9,8
|
2,0
|
-3, +3, +5
|
613
|
5,7
|
|
51
|
Сурьма (Sb)
|
121,75
|
[Kr] 4d105s25p3
|
0,141
|
8,6
|
1,9
|
-3, +3,
+4, +5
|
630,7
|
1750
|
6,68
|
83
|
Висмут (Bi)
|
208,98
|
[Xe] 4f145d106s26p3
|
0,152
|
7,8
|
1,9
|
+3, +5
|
271,3
|
1560
|
9,78
|
В ряду –N – P – As – Sb – Bi ® увеличиваются
размеры атомов, ослабляется притяжение валентных электронов к ядру, ослабляются
неметаллические свойства, возрастают металлические свойства, ЭО уменьшается.
N, P - типичные неметаллы
As, Sb - проявляют неметаллические и
металлические свойства
Bi - типичный металл
P, As и Bi существуют в
твердом состоянии в нескольких модификациях.
Строение атомов химических элементов
Название
химического
элемента
|
Схема строения атома
|
Электронное строение последнего энергоуровня
|
Формула высшего оксида R2O5
|
Формула летучего водородного
соединения
RH3
|
1. Азот
|
N+7)2)5
|
…2s22p3
|
N2O5
|
NH3
|
2. Фосфор
|
P+15)2)8)5
|
…3s23p3
|
P2O5
|
PH3
|
3. Мышьяк
|
As+33)2)8)18)5
|
…4s24p3
|
As2O5
|
AsH3
|
4. Сурьма
|
Sb+51)2)8)18)18)5
|
…5s25p3
|
Sb2O5
|
SbH3
|
5. Висмут
|
Bi+83)2)8)18)32)18)5
|
…6s26p3
|
Bi2O5
|
BiH3
|
Элементы группы азота образуют с водородом соединения
состава RH3, а с кислородом оксиды вида - R2O3 и R2O5. Оксидам
соответствуют кислоты HRO2 и
HRO3 (и ортокислоты H3PO4,
кроме азота).
Высшая степень окисления этих элементов равна +5, а
низшая -3.
Так как заряд ядра атомов увеличивается,
число электронов на внешнем уровне постоянно, число энергетических уровней в
атомах растёт и радиус атома увеличивается от азота к висмуту, притяжение
отрицательных электронов к положительному ядру ослабевает и способность к отдаче электронов
увеличивается, и, следовательно, в подгруппе азота с ростом порядкового номера неметаллические свойства убывают, а металлические
усиливаются.
Азот - неметалл, висмут - металл. От азота к висмуту
прочность соединений RH3 уменьшается,
а прочность кислородных соединений возрастает.
Наибольшее
значение среди элементов подгруппы азота имеют азот и фосфор .
Важнейшие
формы кислотных оксидов элементов данной подгруппы Э2О3 и Э2О5, им соответствуют
кислоты типа НЭО2 или Н3ЭО3
и НЭО3 или Н3ЭО4:
Азот, физические и
химические свойства, получение и применение
1.
Азот – химический элемент
N +7)2)5
1s22s22p3 незавершённый
внешний уровень, p-элемент, неметалл
Ar(N)=14
2. Возможные степени
окисления
Из-за наличия трёх неспаренных электронов азот очень
активен, находится только в виде соединений. Азот проявляет в соединениях
степени окисления от «-3» до «+5»
3. Азот – простое
вещество, строение молекулы, физические свойства
Азо́т (от греч. ἀζωτος —
безжизненный, лат. Nitrogenium), вместо предыдущих названий
(«флогистированный», «мефитический» и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье. Как показано выше, в
то время уже было известно, что азот не поддерживает ни горения, ни дыхания.
Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот,
наоборот, крайне необходим для всех живых существ, название сохранилось во
французском и русском языках.
N2 – ковалентная
неполярная связь, тройная (σ, 2π), молекулярная кристаллическая решётка
Тройная
связь
|
Энергия
связи
945 кДж/моль
|
Вывод:
1. Малая реакционная способность при
обычной температуре
2. Газ, без цвета, запаха, легче
воздуха
Mr(Bоздуха)/Mr(N2) = 29/28
4. Химические свойства
азота
5. Получение:
В промышленности азот получают из
воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух
подвергают перегонке (дистилляции). Температура кипения азота немного ниже
(–195,8°C), чем другого компонента воздуха — кислорода (–182,9°C), поэтому при
осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям
газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных
баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара.
В лаборатории чистый
(«химический») азот получают добавляя при нагревании насыщенный раствор хлорида
аммония NH4Cl к твердому нитриту натрия NaNO2:
NaNO2 +
NH4Cl = NaCl + N2 + 2H2O.
Можно также нагревать твердый нитрит аммония:
NH4NO2 = N2 +
2H2O.
6. Применение:
В промышленности газ азот используют главным образом
для получения аммиака. Как химически инертный газ азот применяют для
обеспечения инертной среды в различных химических и металлургических процессах,
при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент,
его применяют в медицине, особенно в косметологии. Важное значение в
поддержании плодородия почв имеют азотные минеральные удобрения.
Азот является элементом, необходимым для существования животных и растений,
он входит в состав белков (16—18 % по массе),аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла,гемоглобина и др. В составе живых
клеток по числу атомов азота около 2%, по массовой доле - около 2,5 %
(четвертое место после водорода, углерода и кислорода). В связи с этим
значительное количество связанного азота содержится в живых организмах,
«мёртвой органике» и дисперсном веществе морей и океанов. Это количество
оценивается примерно в 1,9·1011 т. В результате процессов
гниения и разложения азотсодержащей органики, при условии благоприятных
факторов окружающей среды, могут образоваться природные залежи полезных
ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других
соединений), норвежская, индийская селитры.
Аммиак – NH3
Аммиак (в
европейских языках его название звучит как «аммониак») своим названием обязан
оазису Аммона в Северной Африке, расположенному на перекрестке караванных
путей. В жарком климате мочевина (NH2)2CO, содержащаяся в
продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из
продуктов разложения и является аммиак. По другим сведениям, аммиак получил
своё название от древнеегипетского слова амониан. Так называли
людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали
нашатырь NH4Cl, который при нагревании испаряет аммиак.
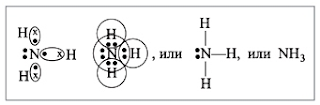
1.
Строение молекулы
Молекула аммиака имеет форму
тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в
образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода
(связи N−H), четвёртая пара внешних электронов является неподелённой, она может
образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид
химической связи: ковалентная полярная, три одинарные σ - сигма связи N-H
2.
Физические свойства аммиака
При
нормальных условиях — бесцветный газ с резким характерным запахом (запах
нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ
удушающего и нейротропного действия, способных при ингаляционном поражении
вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары
аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также
кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают
обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы,
потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около
1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
В лаборатории
|
В промышленности
|
Для
получения аммиака в лаборатории используют действие сильных щелочей на соли
аммония:
NH4Cl + NaOH = NH3↑
+ NaCl + H2O
(NH4)2SO4 +
Ca(OH)2 = 2NH3↑ + CaSO4+ 2H2O
Внимание! Гидроксид
аммония неустойчивое основание, разлагается:NH4OH ↔ NH3↑ + H2O
При
получении аммиака держите пробирку - приёмник дном кверху, так как аммиак
легче воздуха:
|
Промышленный
способ получения аммиака основан на прямом взаимодействии водорода и азота:
Условия:
катализатор
– пористое железо
температура
– 450 – 500 ˚С
давление –
25 – 30 МПа
Это так
называемый процесс Габера (немецкий физик, разработал физико-химические
основы метода).
|
4.
Химические свойства аммиака
Для аммиака характерны
реакции:
- с изменением степени окисления
атома азота (реакции окисления)
- без изменения степени окисления
атома азота (присоединение)
Реакции с изменением степени
окисления атома азота (реакции окисления)
N-3 → N0 → N+2
NH3 – сильный восстановитель.
|
с кислородом
4NH3 + 3O2 → 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt – Rh,
температура)
4NH3 + 5O2 → 4NO + 6H2O
|
с оксидами металлов
2 NH3 + 3CuO = 3Cu + N2 + 3 H2O
|
с сильными окислителями
2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
|
аммиак – непрочное соединение, при
нагревании разлагается
2NH3↔ N2 + 3H2
|
Взаимодействие с кислотами (в
результате образуются средние и кислые соли):
Аммиак взаимодействует с солями
некоторых металлов с образованием комплексных соединений – аммиакатов:
Реакции без
изменения степени окисления атома азота (присоединение - Образование иона
аммония NH4+ по донорно-акцепторному механизму)
Применение
аммиака
По
объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире
получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком
виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25%
NH3. Огромные количества аммиака далее используются для получения азотной кислоты,
которая идет напроизводство удобрений и
множества других продуктов. Аммиачную воду применяют также непосредственно в
виде удобрения, а иногда поля поливают из цистерн непосредственно жидким
аммиаком. Из аммиака получают
различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных
холодильных установках.
Аммиак
используется также для
получения синтетических волокон, например, найлона и капрона. В легкой
промышленности он используется
при очистке и крашении хлопка, шерсти и шелка. В нефтехимической
промышленности аммиак используют для нейтрализации кислотных отходов, а в
производстве природного каучука аммиак помогает сохранить латекс в процессе его
перевозки от плантации до завода. Аммиак используется также при производстве
соды по методу Сольве. В сталелитейной промышленности аммиак используют для
азотирования – насыщения поверхностных слоев стали азотом, что значительно
увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном
спирте, выводит человека из обморочного состояния. Для человека аммиак в такой
дозе не опасен.
Соли
аммония - это
сложные вещества, в состав которых входят ионы аммония NH4+, соединённые с кислотными
остатками.
Например,
NH4Cl – хлорид аммония
(NH4)2SO4 - сульфат аммония
NH4NO3 – нитрат аммония
(NH4)3PO4 – ортофосфат аммония
(NH4)2HPO4 – гидроортофосфат аммония
NH4H2PO4 – дигидроортофосфат аммония
Физические свойства
Кристаллические
вещества, хорошо растворимые в воде.
Получение
1 способ- Аммиак + кислота: NH3 + HNO3 → NH4NO3
2 способ- Аммиачная вода + кислота: 2NH4OH + H2SO4 → (NH4)2SO4+ 2Н2O
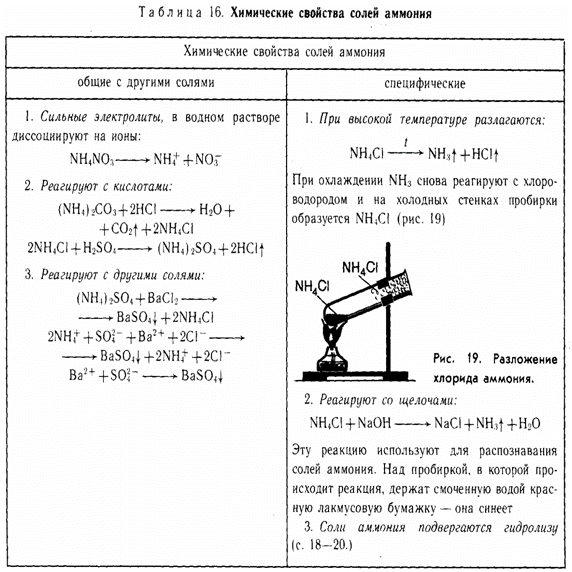
Химические свойства
ОБЩИЕ
1.
Сильные
электролиты (диссоциируют в водных растворах)
NH4Cl → NH4+ + Cl-
2. С
кислотами (реакция обмена)
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
3. С солями (реакция обмена)
(NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4 ↓
СПЕЦИФИЧЕСКИЕ
1. Разложение при нагревании.
a)
если кислота летучая
NH4Cl → NH3 + HCl (при
нагревании)
NH4HCO3 → NH3 + Н2O
+ CO2
б) если
анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O (при
нагревании)
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O (при
нагревании)
2. Качественная реакция на NH4+ - ион аммония. При нагревании со щелочами выделяется
газ аммиак
NH4Cl + NaOH → NaCl + NH3 + Н2O (при
нагревании)
3. Соли
аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) –
среда кислая:
NH4Cl + Н2O → NH4OH +
HCl
NH4+ + Н2O → NH4OH
+ H+
Применение
- Нитрат аммония (аммиачная
селитра) NH4NO3 применяют как азотное удобрение
и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония
(NH4)2SO4 — как дешёвое азотное
удобрение;
- Гидрокарбонат аммония NH4HCO3 и карбонат
аммония (NH4)2CO3 — в пищевой промышленности при
производстве мучных кондитерских изделий в качестве химического
разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония (нашатырь) NH4Cl — в гальванических
элементах (сухих батареях), при пайке и лужении, в текстильной
промышленности, как удобрение, в ветеринарии.
УПРАЖНЕНИЯ
1. Запишите уравнения реакций
взаимодействия между следующими веществами:
а)
растворами нитрита натрия и хлорида аммония;
б)
золотом и царской водкой.
Решение:
А) При нагревании смеси растворов нитрита натрия и
хлорида аммония при 80 °С образуется азот:
NaNO2 + NH4Cl = N2 + 2H2O + NaCl.
Б) Смесь концентрированных азотной и соляной кислот в
объемном соотношении 1 : 3 называется «царской водкой», реагирует с
золотом согласно уравнению:
HNO3 + 4HCl + Au = H[AuCl4] + NO
+ 2H2O.
________________________________________________________________
2. Вычислите массу меди,
образующуюся при восстановлении оксида меди (II) аммиаком, полученном при
взаимодействии 11,2 л азота (н. у.) с водородом.
Решение:
Запишем уравнение реакции восстановления оксида меди
(II) аммиаком:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
(1)
Аммиак образуется по реакции:
N2 +
3H2 = 2NH3
(2)
Для вычисления массы полученной меди необходимо знать
количество образующегося аммиака. По уравнению (2) из 1 моль азота образуется 2
моль аммиака, то есть соотношение n (N2) : n (NH3) = 1 : 2.
Вычислим количество азота, вступившего в реакцию:
,
следовательно, аммиака образуется 1 моль.
По уравнению реакции (2) 2 моль аммиака соответствует
3 моль меди, то есть соотношение n (NH3) : n (Cu) = 2 : 3,
в реакцию вступает 1 моль аммиака, следовательно, образуется 1,5 моль меди.
Вычислим массу образующейся меди:
m (Cu) = n (Cu) · M (Cu) = 1,5 · 64 = 96 (г).
Ответ: m (Cu) = 96
г.
________________________________________________________________
3. Важнейшая
проблема в промышленном производстве удобрений - получение так называемого
"связанного азота". В настоящее время ее решают путем синтеза аммиака
из азота и водорода. Какой объем аммиака (при н.у.) можно получить в этом
процессе, если объем исходного водорода равен 300 л, а практический выход (z) -
43 %?
Решение:
Запишем
уравнение реакции и условие задачи в формульном виде:
N2 + 3H2 = 2NH3
V(H2) = 300 л; z(NH3) = 43% = 0,43
V(NH3) = ? (н.у.)
Объем
аммиака V(NH3),
который можно получить в соответствии с условием задачи, составляет:
V(NH3)практ = V(NH3)теор . z(NH3) = 2/3 . V(H2) . z(NH3) =
=
2/3 . 300 . 0,45 [л] = 86 л
Ответ. 86 л (при н.у.) аммиака.
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Осуществите
превращения по схеме:
N2→Li3N→NH3
2. Составьте уравнения реакции взаимодействия азота с кислородом, магнием и водородом. Для каждой реакции составьте электронный баланс, укажите окислитель и восстановитель.
N2→Li3N→NH3
2. Составьте уравнения реакции взаимодействия азота с кислородом, магнием и водородом. Для каждой реакции составьте электронный баланс, укажите окислитель и восстановитель.
3. В одном
цилиндре находится газ азот, в другом - кислород, а в третьем - углекислый газ.
Как различить эти газы?
4. В некоторых горючих газах содержится в виде примеси свободный азот. Может ли при сгорании таких газов в обыкновенных газовых плитах образоваться оксид азота (II). Почему?
4. В некоторых горючих газах содержится в виде примеси свободный азот. Может ли при сгорании таких газов в обыкновенных газовых плитах образоваться оксид азота (II). Почему?
5. Осуществить превращения по
схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить
е-баланс, для РИО полные, ионные уравнения.
6. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
6. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
7. Смешали 5 г аммиака и 5 г
хлороводорода. Что оказалось в избытке и какова масса этого избытка.
8. Вычислите объемы (при н.у.) азота и
водорода, необходимые для получения 17 т аммиака.
9. Соединением 3,648 г Mg с азотом
получено 5,048 г нитрида магния. Найдите его формулу.
10. Запишите уравнения практически
осуществимых реакций:
ВИДЕО ОПЫТ
1.
Охарактеризуйте реакцию синтеза аммиака:
|
|
а) обратимая
|
б) окислительно-восстановительная
|
в) экзотермическая
|
г) все ответы верны
|
2.
Атом азота
имеет промежуточную степень окисления в составе:
|
|
а) нитратов
|
б) нитритов
|
в) нитридов
|
г) селитр
|
3.
Взаимодействие аммиака с кислотами относится к
типу реакций:
|
|
а) замещения
|
б) соединения
|
в) разложения
|
г) обмена
|
4.
С азотом при обычных условиях реагирует:
|
|
а) кислород
|
б) хлор
|
в) литий
|
г) углерод
|
5.
Плотность газовой смеси, предназначенной для
синтеза аммиака, составляет 0,5 г/л. Объемная доля (%) водорода в смеси
равна:
|
|
а) 64,6
|
б) 55,4
|
в) 45,3
|
г) 70,1
|
6.
Аммиак можно получить:
|
|
а) взаимодействием нитрида кальция с
водой
|
б) термическим разложением
гидрокарбоната аммония
|
в) взаимодействием соли аммония со
щелочью
|
г) все ответы верны
|
7.
Неверным для азота является утверждение:
|
|
а) не имеет аллотротных модификаций
|
б) в природе находится только в
свободном виде
|
в) высшая степень окисления азота в
соединениях равна +5
|
г) высшая валентность атома азота
составляет (IV)
|
8.
Бинарные (двухэлементные) соединения металлов с
азотом называются:
|
|
а) карбиды
|
б) амины
|
в) нитраты
|
г) нитриды
|
9.
Азот в лаборатории получают:
|
|
а) из воздуха
|
б) термическим разложением нитрита
аммония
|
в) взаимодействием меди с НNO3(конц.)
|
г)взаимодействием меди с НNO3(разб.)
|
10.
Какой объем
газа (л, н.у.) получится при нагревании смеси, состоящей из 10,7 г NH4Cl и избытка
Ca(OH)2:
|
|
а) 3,57
|
б) 4,48
|
в) 3,75
|
г) 4,15
|
Ответы:
1
|
г
|
2
|
б
|
3
|
б
|
4
|
в
|
5
|
а
|
6
|
г
|
7
|
б
|
8
|
г
|
9
|
б
|
10
|
б
|






















Комментариев нет:
Отправить комментарий