4.2. Тепловые эффекты реакций. Закон Гесса и
следствия из него
В каждом веществе запасено определенное количество энергии. В организме эта
энергия преобразуется в движение, работу, идет на поддержание постоянной (и
довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических
связях. Чтобы разрушить связь между двумя атомами, требуется ЗАТРАТИТЬ ЭНЕРГИЮ.
Когда химическая связь образуется, энергия ВЫДЕЛЯЕТСЯ.
Когда в результате химической реакции при образовании новых связей
выделяется энергии БОЛЬШЕ, чем потребовалось для разрушения "старых"
связей в исходных веществах, то избыток энергии высвобождается в виде тепла.
Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает
в кислороде воздуха с выделением большого количества теплоты. Реакция даже
может идти со взрывом - так много энергии заключено в этом превращении. Такие
реакции называются ЭКЗОТЕРМИЧЕСКИМИ от латинского "экзо" - наружу
(имея в виду выделяющуюся энергию).
В других случаях на разрушение связей в исходных веществах требуется
энергии больше, чем может выделиться при образовании новых связей. Такие
реакции происходят только при подводе энергии извне и называются
ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является
образование оксида углерода (II) CO и водорода H2 из
угля и воды, которое происходит только при нагревании.
Уравнение реакции горения метана
Уравнение реакции между углем и водой при высокой температуре
Изображение химических реакций при
помощи моделей молекул: а) экзотермическая реакция, б) эндотермическая реакция.
Модели наглядно показывают, как при неизменном числе атомов
между ними разрушаются старые и возникают новые химические связи.
Таким образом, любая химическая реакция сопровождается выделением или
поглощением энергии. Чаще всего энергия выделяется или поглощается в виде
теплоты (реже - в виде световой или механической энергии). Эту
теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для
одного МОЛЯ реагента или (реже) для моля продукта реакции. Такая величина
называется ТЕПЛОВЫМ ЭФФЕКТОМ РЕАКЦИИ.
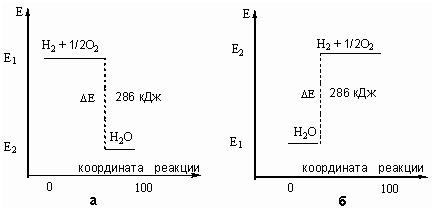
Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить
любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект
экзотермической реакции образования воды из водорода и кислорода. Первое - на
1 моль использованного кислорода, а второе - на 1 моль сгоревшего
водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ.
Встречаются также обозначения (тв) или (к) - твердое, кристаллическое
вещество, (водн) - растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение. Например,
в реакции сгорания водорода первоначально образуется вода в виде пара
(газообразное состояние), при конденсации которого может выделиться еще
некоторое количество энергии. Следовательно, для образования воды в виде
жидкости измеренный тепловой эффект реакции будет несколько больше, чем для
образования только пара, поскольку при конденсации пара выделится еще порция
теплоты.
Используется также частный случай теплового эффекта реакции - ТЕПЛОТА
СГОРАНИЯ. Из самого названия видно, что теплота сгорания служит для
характеристики вещества, применяемого в качестве топлива. Теплоту сгорания
относят к 1 молю вещества, являющегося топливом (восстановителем в реакции
окисления), например:
C2H2
|
+
|
2,5 O2
|
=
|
2 CO2
|
+
|
H2O
|
+
|
1300 кДж
|
ацетилен
|
теплота сгорания ацетилена
|
Запасенную в молекулах
энергию (Е) можно отложить на энергетической шкале. В этом случае тепловой
эффект реакции (ΔЕ) можно показать графически.
Графическое изображение теплового
эффекта (Q = ΔЕ):
а) экзотермической реакции горения водорода; б) эндотермической
реакции разложения воды под действием электрического тока. Координату реакции
(горизонтальную ось графика) можно рассматривать, например, как степень
превращения веществ (100% - полное превращение исходных веществ).
Тепловые эффекты химических реакций нужны для многих технических расчетов.
Без помощи теплового эффекта реакции образования воды из водорода и
кислорода сделать это затруднительно. Ведь тепловой эффект - это и
есть та самая энергия, которая должна вывести ракету на орбиту. В камерах
сгорания ракеты эта теплота превращается в кинетическую энергию молекул
раскаленного газа (пара), который вырывается из сопел и создает реактивную
тягу.
Уравнения химических реакций, в которых вместе с реагентами и продуктами
записан и тепловой эффект реакции, называются
ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ.
Особенность термохимических уравнений заключается в том, что при работе с
ними можно переносить формулы веществ и величины тепловых эффектов из одной
части уравнения в другую. С обычными уравнениями химических реакций так
поступать, как правило, нельзя.
Допускается также почленное сложение и вычитание термохимических уравнений.
Это бывает нужно для определения тепловых эффектов реакций, которые трудно или
невозможно измерить в опыте.
Закон Гесса
Как
известно, большинство химических реакций сопровождаются выделением (экзотермические
реакции) либо поглощением (эндотермические реакции)
теплоты. Первое начало термодинамики дает возможность рассчитать тепловой
эффект химической реакции при различных условиях её проведения.
Тепловой
эффект (теплота) химической реакции – количество теплоты, выделившейся либо
поглотившейся в ходе реакции. Тепловой эффект относят, как правило, к числу
молей прореагировавшего исходного вещества, стехиометрический коэффициент перед
которым максимален.
Например,
реакцию окисления водорода в химической термодинамике записывают в виде:
Н2 + 1/2 О2 ––> Н2О
и
тепловой эффект рассчитывают на 1 моль водорода.
Тепловые
эффекты, сопровождающие протекание химических реакций, являются предметом
одного из разделов химической термодинамики – термохимии. Определим некоторые
понятия термохимии.
Теплота
образования вещества –
тепловой эффект реакции образования 1 моля сложного вещества из простых.
Теплоты образования простых веществ принимаются равными нулю.
Теплота
сгорания вещества –
тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших
устойчивых оксидов.
Теплота
растворения –
тепловой эффект процесса растворения 1 моля вещества в бесконечно большом
количестве растворителя. Теплота растворения складывается из двух составляющих:
теплоты разрушения кристаллической решетки (для твердого вещества) и теплоты
сольватации:
Поскольку
ΔНкр.реш всегда
положительно (на разрушение кристаллической решетки необходимо затратить
энергию), а ΔНсольв всегда
отрицательно, знак ΔНраств определяется соотношением
абсолютных величин ΔНкр.реш и
ΔНсольв:
Основным
законом термохимии является закон Гесса,
являющийся частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в
изобарно-изотермических или изохорно-изотермических условиях, зависит только от
вида и состояния исходных веществ и продуктов реакции и не зависит от пути её
протекания.
Выше было
показано, что изменение энтальпии ΔН (тепловой эффект изобарного процесса Qp)
и изменение внутренней энергии ΔU (тепловой эффект изохорного процесса Qv)
не зависят от пути, по которому система переходит из начального состояния в
конечное.
Рассмотрим
некоторый обобщенный химический процесс превращения исходных веществ А1,
А2, А3... в продукты реакции В1, В2,
В3..., который может быть осуществлен различными путями в одну или
несколько стадий:
Согласно
закону Гесса, тепловые эффекты всех этих реакций связаны следующим
соотношением:
Практическое
значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые
эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой
эффект прямой реакции равен по величине и противоположен по знаку тепловому
эффекту обратной реакции (закон Лавуазье – Лапласа).
2. Для
двух реакций, имеющих одинаковые исходные, но разные конечные состояния,
разность тепловых эффектов представляет собой тепловой эффект перехода из
одного конечного состояния в другое.
С + О2
––> СО + 1/2 О2
ΔН1
С + О2
––> СО2
ΔН2
СО + 1/2 О2 ––> СО2
ΔН3
3. Для
двух реакций, имеющих одинаковые конечные, но разные исходные состояния,
разность тепловых эффектов представляет собой тепловой эффект перехода из
одного исходного состояния в другое.
С(алмаз) + О2 ––> СО2
ΔН1
С(графит) + О2 ––> СО2
ΔН2
С(алмаз) ––> С(графит)
ΔН3
4. Тепловой
эффект химической реакции равен разности сумм теплот образования продуктов
реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
5. Тепловой
эффект химической реакции равен разности сумм теплот сгорания исходных веществ
и продуктов реакции, умноженных на стехиометрические коэффициенты.
В
качестве примера рассмотрим расчет теплового эффекта реакции окисления одного
моля глюкозы (теплота образования кислорода по определению равна нулю):
С6Н12О6 + 6 О2 ––> 6 СО2 + 6 Н2О
Величины
тепловых эффектов химических реакций зависят от условий, в которых проводятся
реакции. Поэтому табличные значения теплот различных процессов принято относить
к стандартному состоянию – температуре 298 К и давлению 101325 Па (760 мм. рт.
ст.; 1 атм.); величины тепловых эффектов при данных условиях называют
стандартными тепловыми эффектами и обозначают ΔН°298 и ΔU°298 соответственно.
Алгоритм
решения задач по термохимическому уравнению реакции
1. Кратко записать условия задачи
(“дано”).
2. Записать термохимическое уравнение
реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно,
двумя чертами подчёркивают то, что необходимо определить.
3. Провести вспомогательные вычисления
(корень квадратный, Мr, М, m).
4. Составить соотношение, используя
вспомогательные вычисления и условия задачи; решить соотношение (пропорцию).
5. Записать ответ.
Пример задачи
Ответ: 2Са + О2 —> 2СаО
+ 5080 кДж
Решение:
1.
х= 20*
5654/337 = 38,81 кДж
Ответ: 38,81 кДж.
УПРАЖНЕНИЯ
1.
Вычислите массу разложившегося мела (СаСО3),
если известно, что на его разложение затрачено 1570 кДж.
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 +
16 3 = 100
Мr = Мr m = v * М
M(СаСО3)
= 1 моль* 100 г/моль = 100г
100г СаСО3 - 157
кДж -
х г СаСО3 - 1570
кДж
100г :
157 кДж = х г : 1570 кДж
х =
1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г
мела)
_____________________________________________________________
2. При сгорании 56 л водорода выделилось
605 кДж теплоты. Вычислите тепловой эффект реакции горения водорода
Решение:
1.
Найдем количество вещества сгоревшего водорода:
n(H2) = v/22,4 л/моль = 56 л : 22,4 л/моль = 2,5 моль,
где 22,4 — молярный объем газа при н.у. (нормальных условиях)
n(H2) = v/22,4 л/моль = 56 л : 22,4 л/моль = 2,5 моль,
где 22,4 — молярный объем газа при н.у. (нормальных условиях)
2.
Запишем над уравнением реакции имеющиеся данные, а
под уравнением — число моль:
2,5 моль 605 кДж
2H2 + O2 = 2H2O + Q
2 моль х кДж
2,5 моль 605 кДж
2H2 + O2 = 2H2O + Q
2 моль х кДж
3.
Составим пропорцию:
2,5 моль — 605 кДж
2 моль — х кДж
и найдем x:
x = 2 моль • 605 кДж / 2,5 моль = 484 кДж
2,5 моль — 605 кДж
2 моль — х кДж
и найдем x:
x = 2 моль • 605 кДж / 2,5 моль = 484 кДж
4.
Запишем уравнение, подставив вместо Q найденное значение:
2H2 + O2 = 2H2O + 484 кДж
или (сокращаем на 2)
H2 + 1/2O2 = H2O + 242 кДж
2H2 + O2 = 2H2O + 484 кДж
или (сокращаем на 2)
H2 + 1/2O2 = H2O + 242 кДж
Ответ: 2H2 + O2 = 2H2O
+ 484 кДж, или
H2 + 1/2O2 = H2O + 242 кДж
H2 + 1/2O2 = H2O + 242 кДж
_____________________________________________________________
3.
4.
_____________________________________________________________
5.
_____________________________________________________________
6.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Какая
запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394
кДж
б) СаСO3 =
СO2 + СаО – 310 кДж
в) Н2 +
I2 = 2HI – 52 кДж
г) 3Fe + O2 = Fe3O4 + 118 кДж
2.Определите
величину теплового эффекта реакции:
2 S + 3 O2 = 2 SO3
если известны тепловые эффекты реакций
а) S + O2 = SO2 + 297 кДж/моль
б) SO2 +
0,5 O2 = SO3 + 396 кДж/моль
3. На
основании двух термохимических уравнений определите, что устойчивее - алмаз
или графит?
С (графит) + O2 =
СO2 + 393,8 кДж
С (алмаз) + O2 =
СO2 + 395,7 кДж
4. Установите соответствие между схемой
реакции и её типом:
А) СH4(г) + 2 O2(г) = СO2(г)
+ 2 H2О(ж) + 890 кДж
Б) 2 H2О = 2 H2 + О2 – 572 кДж
1.
Эндотермическая реакция
2.
Экзотермическая реакция
5. Приведены
уравнения реакций:
А. СаО + Н2О = Са(ОН)2
Б. 2HgO = 2Hg + O2
Определите тип, к которому относятся данные реакции.
2) обе
реакции эндотермические
3) А –
эндотермическая, а Б – экзотермическая
4) А –
экзотермическая, а Б – эндотермическая
6. Вычислите тепловой эффект
реакции восстановления оксида железа (II) водородом, исходя из следующих
термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г); ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г) ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г) ΔН3 = -241,83 кДж.
1. FeO (к) + CO (г) = Fe (к) + CО2 (г); ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г) ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г) ΔН3 = -241,83 кДж.
7. Составьте
термохимическое уравнение образования воды (жидкой) из простых веществ, если
известно, что при образовании 1 моля воды выделяется 286 кДж теплоты.
8. Составьте
термохимическое уравнение образования воды (газообразной) из простых веществ,
если известно, что при образовании 9 г Н2О (г) выделяется 123 кДж
теплоты. Обратите внимание, что при образовании воды в разном агрегатном
состоянии - Н2О (г) и Н2О (ж) – выделяется разное
количество теплоты.
9.
По термохимическому уравнению S (тв.) + О2(г) = SО2(г);
рассчитайте:
а) какое количество
теплоты выделится при сгорании 640 г серы;
б) сколько литров кислорода (н.у.) вступает в реакцию, если при этом
выделяется 59,4 кДж теплоты; в) сколько
граммов серы сгорело, если известно, что выделилось 594 кДж теплоты.
10.
Определите тепловой эффект реакции горения этанола:
по теплотам образования веществ, участвующих в
реакции.
|
1.
Термохимия – это:
|
|
|
а) раздел химии, изучающий тепловые эффекты химических реакций и фазовых
превращений
|
б) раздел химии, изучающий кинетические закономерности реакции
|
|
в) раздел химии, изучающий таутомерные и изомерные превращения
органических соединений
|
г) раздел химии, изучающий неорганические кристаллы
|
|
2.
Величина,
характеризующая состояние термодинамического (теплового) равновесия
макроскопической системы, – это:
|
|
|
а) давление;
|
б) температура
|
|
в) объем
|
г) концентрация
|
|
3.
Тепловой эффект
реакции окисления кислородом элементов, входящих в состав вещества, до
образования высших оксидов называется:
|
|
|
а) теплотой сгорания этого вещества;
|
б) теплотой возгонки этого вещества
|
|
в) теплотой адсорбции этого вещества
|
г) теплотой десорбции этого вещества
|
|
4.
Согласно правилу
Вант-Гоффа при повышении температуры на 10 К скорость многих реакций:
|
|
|
а) увеличивается в 2–4 раза;
|
б) увеличивается в 5–10 раз
|
|
в) уменьшается в 2–4 раза;
|
г) уменьшается в 5–10 раз
|
|
5.
Выберите верное
утверждение:
|
|
|
а) адсорбция – экзотермический процесс;
|
б) адсорбция увеличивается с увеличением температуры
|
|
в) адсорбция уменьшается с увеличением концентрации адсорбирующихся
веществ
|
г) адсорбция – эндотермический
процесс
|
|
6.
Выберите верное
утверждение:
|
|
|
а) частицы, энергия которых ниже энергии активации, называют активными;
|
б) с увеличением энергии активации уменьшается доля активных молекул
|
|
в) с увеличением энергии активации увеличивается скорость реакции
|
г) все вышеперечисленные
утверждения верны
|
|
7.
Полная энергия
системы определяется:
|
|
|
а) запасом ее внутренней энергии;
|
б) запасом ее потенциальной энергии
|
|
в) запасом произведения внутренней, кинетической и потенциальной энергий
|
г) запасом ее кинетической энергии
|
|
8.
Сумма коэффициентов
продуктов реакции йодоводородной кислоты с хромовой кислотой равна:
|
|
|
а) 9
|
б)14
|
|
в)15
|
г)16
|
|
9.
При взаимодействии
хлорида аммония и амида калия исходные реагенты выступают соответственно в
таком качестве:
|
|
|
а) оба – кислоты;
|
б) основания и кислоты
|
|
в) кислоты и основания
|
г) оба – основания
|
|
10.
Если поршень
закреплен неподвижно (при постоянном объеме), то сообщенная системе теплота
полностью идет на:
|
|
|
а) увеличение запаса
внутренней энергии;
|
б) уменьшение запаса внутренней энергии
|
|
в) уменьшение запаса кинетической энергии
|
г) уменьшение запаса потенциальной энергии
|
Ответы:
|
1
|
а
|
|
2
|
б
|
|
3
|
а
|
|
4
|
а
|
|
5
|
а
|
|
6
|
б
|
|
7
|
а
|
|
8
|
а
|
|
9
|
в
|
|
10
|
а
|






















Комментариев нет:
Отправить комментарий