3.5. Периодическая система химических элементов и
электронное строение атомов
В атомах
элементов I периода ( Н и Не) электроны заполняют один энергетический уровень (К); в атомах элементов II периода (от Li до Ne) электроны заполняют два энергетических уровня (К и L);
в атомах элементов III периода (от Na до Ar) – три энергетических уровня (К, L и
М); в атомах элементов IV периода (от К до Кr) – четыре энергетических уровня (К, L, М и
N).
Число заполняемых энергетических уровней (электронных
слоев) в атомах всех элементов данного периода равно номеру периода. Поэтому можно
дать следующее определение периода:
Период – это последовательность элементов, атомы
которых имеют одинаковое число электронных слоев. Это число равно номеру
периода.
В
атомах всех известных элементов электроны заполняют от1 до 7 энергетических
уровней, поэтому периодическая система состоит из семи периодов.
Каждый
период начинается щелочным металлом, в атомах которого на внешнем электронном
слое имеется один s-электрон; электронное строение внешнего слоя – ns1 ( n – номер периода).
Каждый
период заканчивается благородным газом. В атомах всех благородных газов (кроме
Не) на внешнем электронном слое имеются два s- и шесть p-электронов, электронное строение внешнего слоя ns2np6 (n – номер периода).
Следовательно,
число электронов на внешнем слое атомов элементов главных подгрупп (кроме Н и
Не) равно номеру группы, в которой находятся элементы.
Поэтому
главную подгруппу любой группы можно определить так:
Главная
подгруппа – это вертикальный ряд элементов, атомы которых имеют одинаковое
число электронов на внешнем электронном слое. Это число равно номеру группы.
Периодическое
изменение свойств химических элементов и их соединений при увеличении
порядкового номера объясняется тем, что периодически повторяется строение
внешнего электронного слоя в атомах элементов.
Все
элементы разделяются на 4 электронных семейства.
s-элементы – это элементы, в
атомах которых последним заполняется s-подуровень внешнего электронного слоя.
Первые
два элемента каждого периода – это s-элементы. Они
составляют главные подгруппы I и II
групп.
p-элементы – это элементы, в
атомах которых последним заполняется p-
подуровень внешнего электронного слоя.
В
каждом периоде имеется шесть p- элементов; они
находятся в конце периода. p-элементы составляют главные подгруппы
III – VIII групп.
d-элементы – это элементы, в
атомах которых последним заполняется d-подуровень предвнешнего электронного
слоя.
В
IV – VI больших периодах имеется по десять d-элементов.
В IV и V периодах они находятся между s- и p-элементами. d-элементы составляют побочные подгруппы
всех восьми групп.
Побочная
подгруппа – это вертикальный ряд d-элементов,
которые имеют одинаковое суммарное число электронов на d-подуровне
предвнешнего слоя и s-подуровне внешнего слоя. Это число обычно равно
номеру группы.
Например:
f-элементы – это элементы, в
атомах которых последним заполняется f-подуровень третьего
снаружи электронного слоя.
f-элементы находятся в VI и
VII периодах. Каждый из этих периодов содержит 14 f-элементов. f-элементами
являются лантаноиды и актиноиды, которые располагаются в нижней части
периодической системы.
УПРАЖНЕНИЯ
1.
Определить число главных и
побочных подгрупп в ПСХЭ.
Решение:
6-м (57La и от 72Hf до 80Hg) периодах равно 10 в каждом случае.
Число переходных элементов равно максимальному числу электронов на d-подуровне (10). Именно поэтому на 3-м (М) уровне на 10 электронов больше, чем на 2-м (L). Поскольку в каждом большом периоде периодической системы Д.И.Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам:
4-й период – Fe–Co–Ni,
5-й период – Ru–Rh–Pd,
6-й период – Os–Ir–Pt,
5-й период – Ru–Rh–Pd,
6-й период – Os–Ir–Pt,
то число побочных подгрупп ... .
(Проверить по периодической системе, сколько в ней главных и побочных подгрупп.)
(Проверить по периодической системе, сколько в ней главных и побочных подгрупп.)
_____________________________________________________________
2. Определить
(по аналогии с переходными элементами) число лантаноидов и актиноидов,
вынесенных в виде самостоятельных рядов вниз периодической системы.
Оно должно быть равно разности между максимальным числом электронов на … и … энергетических уровнях. Это число равно максимальному числу электронов на …-подуровне.
(Сверить вывод с периодической системой.)
Оно должно быть равно разности между максимальным числом электронов на … и … энергетических уровнях. Это число равно максимальному числу электронов на …-подуровне.
(Сверить вывод с периодической системой.)
Таким образом, строгая
периодичность расположения элементов в ПСХЭ полностью
объясняется ... .
Периодическое изменение характера заполнения электронами внешних энергетических уровней вызывает периодические изменения химических свойств элементов и их соединений.
объясняется ... .
Периодическое изменение характера заполнения электронами внешних энергетических уровней вызывает периодические изменения химических свойств элементов и их соединений.
Электронные формулы
элементов 2-го периода:
3Li – 1s22s1,
6С – 1s22s22p2, 9F – 1s22s22p5, |
4Be – 1s22s2,
7N – 1s22s22p3, 10Ne – 1s22s22p6, |
5B – 1s22s22p1,
8O – 1s22s22p4. |
При переходе от Li к Ne
заряд ядра (Z) постепенно увеличивается от +3 до +10, что вызывает
увеличение сил притяжения электронов к ядру. В результате радиусы атомов в этом
ряду уменьшаются.
Элемент
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
r (атома), в нм
|
0,156
|
0,111
|
0,083
|
0,065
|
0,055
|
0,047
|
0,042
|
Поэтому способность
отдавать электроны, ярко выраженная у лития, постепенно ослабевает при переходе
к фтору, являющемуся типичным неметаллом. Элемент фтор в реакциях присоединяет
электроны. Он имеет самую высокую электроотрицательность, равную 4. Начиная со
следующего за неоном элемента натрия (Na, Z = 11), электронные
структуры атомов повторяются. Как следствие, внешние электронные орбитали можно
представить в общем виде, где n – номер периода:
для Li и Na – ns1,
для B и Al – ns2np1, для N и P – …….……. , для F и Cl – …….……. , |
для Be и Mg – ns2,
для C и Si – …….……. , для O и S – …….……. , для Ne и Ar – …….……. . |
В 4-м периоде появляются
переходные элементы, принадлежащие побочным подгруппам. Элементы одной и той же
подгруппы имеют идентичный характер расположения электронов на внешних
электронных уровнях, а принадлежащие к разным подгруппам одной и той же
группы – … .
Например, галогены (главная подгруппа VIIa) – ns2np5 (идентичная конфигурация), элементы побочной подгруппы VIIб – (n – 1)s2(n – 1)p6(n – 1)d5ns2 (cходная конфигурация). Сходство состоит в наличии у атомов обеих подгрупп семи валентных электронов, но их расположение по подуровням существенно отличается.
группы – … .
Например, галогены (главная подгруппа VIIa) – ns2np5 (идентичная конфигурация), элементы побочной подгруппы VIIб – (n – 1)s2(n – 1)p6(n – 1)d5ns2 (cходная конфигурация). Сходство состоит в наличии у атомов обеих подгрупп семи валентных электронов, но их расположение по подуровням существенно отличается.
_____________________________________________________________
3.Привести
конкретные примеры важнейших направлений развития химии на основе
периодического закона и системы химических элементов Д.И.Менделеева.
_____________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО
РЕШЕНИЯ
1. Чему равно число энергетических уровней
(электронных слоев) в атомах всех элементов данного периода.
2. Чему равно
число электронов на внешнем энергетическом уровне атомов элементов главных
подгрупп.
3. Какие элементы
называют: а) s-элементами; б) р-элементами; в) d-эле- ментами; г) f-элементами?
Приведите примеры.
4. Сколько s-, p-, d- и f-элементов
находится в каждом периоде
5. Атомы каких элементов имеют законченные
и незаконченные внешние энергетические уровни.
6. Сколько электронов на внешнем энергетическом
уровне имеют атомы: а) металлов; б) неметаллов.
7. Какой элемент — более активный металл:
а) натрий или рубидий; б) калий или скандий; в) калий или медь? Почему.
8. Какой элемент — более активный
неметалл: а) углерод или азот; б) фосфор или азот; в) хлор или бром; г) теллур
или йод? Почему.
9. Атомы каких трех элементов имеют
структуру внешнего электронного слоя 4s1. Напишите их символы и
названия. К каким электронным семействам они относятся. Чем отличаются они по
электронному строению
10. определите положение элементов в
периодической системе (период, группа, подгруппа) по электронным формулам:
В атоме три
электронных слоя, значит, элемент находится в III периоде.
Последним в
атоме заполняется s-подуровень, следовательно, это элемент главной подгруппы. На внешнем электронном слое атома находятся два
электрона, поэтому это элемент II группы
магний.
|
1.
В каком ряду
указаны символы элементов s,p,d-семейств:
|
|
|
а) Н, He, Li
|
б) H, Ba, Al
|
|
в) Be, C, F
|
г) Mg, P, Cu
|
|
2.
Какова формула высшего оксида элемента III-его периода, в атоме которого в основном
состоянии содержится три неспаренных электрона:
|
|
|
а) Э2О3
|
б) ЭО2
|
|
в) Э2О5
|
г) Э2О7
|
|
3.
Укажите формулу водородного соединения элемента с
атомным номером 32:
|
|
|
а) ЭН2
|
б) ЭН
|
|
в) ЭН3
|
г) ЭН4
|
|
4.
В каком ряду указаны символы элементов, два из
которых находятся в главной подгруппе, а один – в побочной:
|
|
|
а) Cu, Ag, K
|
б) Ti, V, Si
|
|
в) C, N, Zn
|
г) Cr, Fe, Ar
|
|
5.
Какие характеристики атомов находятся в
периодической зависимости от заряда ядра:
|
|
|
а) масса
|
б) радиус
|
|
в) число энергетических уровней
|
г) все ответы верны
|
|
6.
В главных подгруппах расположены элементы:
|
|
|
а) только s- и p-семейств
|
б) все ответы верны
|
|
в) как металлы, так и неметаллы
|
г) с одинаковым числом электронов на
внешнем энергетическом уровне атома для данной подгруппы
|
|
7.
В одном периоде находятся элементы:
|
|
|
а) со схожими химическими свойствами
|
б) с одинаковым радиусом атомов
|
|
в) с одинаковым числом энергетических
уровней
|
г) с одинаковым числом валентных
электронов
|
|
8.
Элемент с
электронной конфигурацией атома …3d54s1:
|
|
|
а) расположен в IV периоде
|
б) все ответы верны
|
|
в) расположен в VI группе побочной
подгруппе
|
г) металл
|
|
9.
В побочных подгруппах расположены элементы:
|
|
|
а) только неметаллы
|
б) только элементы d- и f-семейств
|
|
в) только элементы s- и p-семейств
|
г) только четных рядов больших
периодов
|
|
10.
Зная
положение элемента в Периодической системе нельзя предсказать:
|
|
|
а) максимальную валентность элемента
|
б) нет верного ответа
|
|
в) распространенность элемента в
природе
|
г) формулу высшего оксида
|
Ответы:
|
1
|
г
|
|
2
|
в
|
|
3
|
г
|
|
4
|
в
|
|
5
|
б
|
|
6
|
б
|
|
7
|
в
|
|
8
|
б
|
|
9
|
б
|
|
10
|
в
|



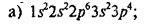

Комментариев нет:
Отправить комментарий